又添证据,痴呆症或可人际传染!研究发现,家族性阿尔茨海默病可通过骨髓移植传染
 2024-04-22
2024-04-22
 5259
5259
阿尔茨海默症(AD),俗称痴呆症,是一个具有高经济和社会负担的全球健康问题。全球约有5000万痴呆症病例,每年新增约有1000万例,在中国,有上千万患者,位居全球第一。尽管科学界投入了许多精力,但目前仍然没有十分有效的治疗方案来预防或治愈阿尔茨海默症。
阿尔茨海默病是由淀粉样β蛋白和tau蛋白积聚引起的,通常分为家族性和散发性疾病。
2024年3月28日,加拿大哥伦比亚大学的研究人员在" Stem Cell Reports "期刊上发表了一篇题为" Conclusive demonstration of iatrogenic Alzheimer’s disease transmission in a model of stem cell transplantation "的研究论文。
这项新研究显示,家族性阿尔茨海默病可以通过骨髓移植转移,将携带遗传性阿尔茨海默病的小鼠的骨髓干细胞移植到正常的小鼠体内时,接受者患上了阿尔茨海默病,而且发病速度加快。

值得一提的是,2024年1月29日,英国伦敦大学学院的研究人员在" Nature Medicine "期刊上发表了一篇题为" Iatrogenic Alzheimer’s disease in recipients of cadaveric pituitary-derived growth hormone "的研究论文。
研究首次发现,阿尔茨海默病可人际传染,其病理学可以以类似朊病毒的方式传播。有5例阿尔茨海默病病例曾接受过被淀粉样β蛋白污染的人类生长激素治疗,最终出现了早发性痴呆症状,符合阿尔茨海默病的诊断标准。表明这些人的阿尔茨海默病是通过医学治疗传播的,并且是由于淀粉样β蛋白的传播所致。

在家族性阿尔茨海默病小鼠模型中,小鼠通常在9-10个月大时开始出现斑块,而认知能力下降的行为迹象在11-12个月时开始出现。与人类相比,这是人类淀粉样蛋白前体蛋白(APP)基因的变体,当其裂解、错误折叠和聚集时,会形成淀粉样斑块,是阿尔茨海默病的标志。
在这项研究中,研究人员在小鼠模型中测试了骨髓来源的淀粉样蛋白是否会导致大脑中阿尔茨海默氏症的发展,对两种不同品系的受体小鼠进行了移植,一种是完全缺乏APP基因的APP敲除小鼠,另一种是携带正常人类APP基因的小鼠。
研究发现,当研究小组将携带遗传性阿尔茨海默病的小鼠的骨髓干细胞移植到正常小鼠体内时,接受者患上了阿尔茨海默病,而且发病速度加快。
具体来说,对于缺乏APP基因的APP敲除小鼠,移植后6个月,小鼠就出现认知能力下降的症状,而对于携带正常APP基因的小鼠,移植后9个月,小鼠就出现认知能力下降的症状。
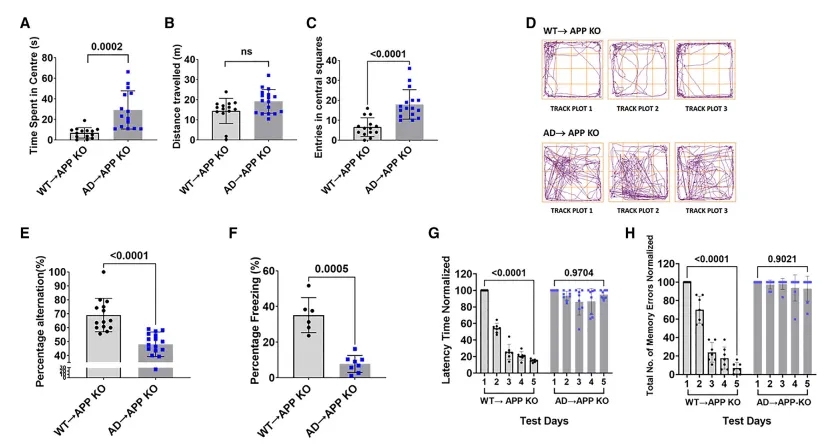
AD小鼠骨髓移植导致受体小鼠认知缺陷
此外,两组受体小鼠还表现出阿尔茨海默病的明显分子和细胞特征,包括血脑屏障渗漏和大脑中淀粉样蛋白的积聚。
对两组小鼠分析还发现,供体细胞中的突变基因会导致疾病,而携带正常APP基因的受体动物易患该疾病,这表明,该疾病可以传播给健康小鼠。
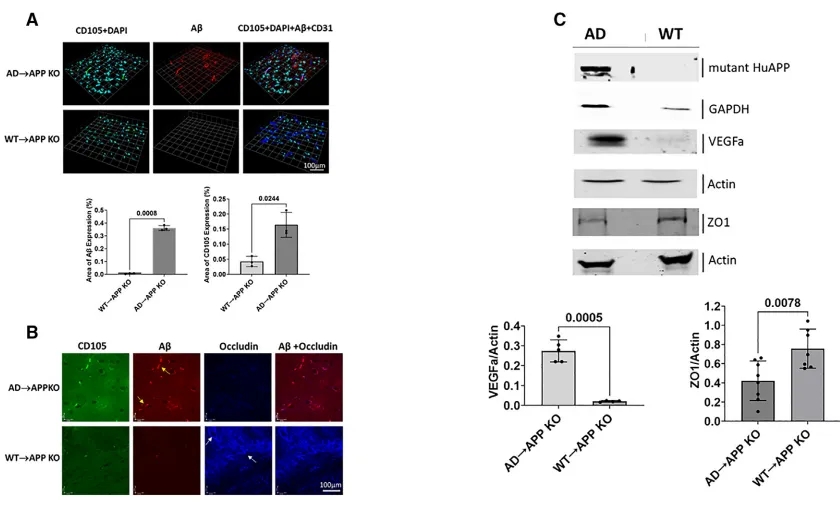
受体小鼠大脑中可见AD病理
因为移植的干细胞是造血细胞,这意味着它们可以发育成血液和免疫细胞,但不能发育成神经元,研究人员对APP敲除小鼠大脑中淀粉样蛋白的证明明确表明,阿尔茨海默病可能是由中枢神经系统外产生的淀粉样蛋白引起的。
最后,由于小鼠疾病的来源是人类APP基因,这意味着,突变的人类基因可以将阿尔茨海默病转移到不同的物种中。
研究人员表示,在未来,他们计划测试将正常小鼠的组织移植到患有家族性阿尔茨海默氏症的小鼠身上,以测试是否可以减轻这种疾病,并测试这种疾病是否也可以通过其他类型的移植或输血传播,并扩大物种转移研究。
这项研究强调了源自大脑外的淀粉样蛋白在阿尔茨海默病发展中的作用,这改变了阿尔茨海默氏病的模式,从一种完全在大脑中产生的疾病转变为一种更具系统性的疾病。
根据结果,研究人员表示,应该对血液、组织、器官和干细胞的捐献者进行阿尔茨海默病筛查,以防止其在血液制品输注和细胞治疗过程中意外传播阿尔茨海默病。
尽管如此,研究人员强调,这种危险尚未在人类身上得到证实,而且即使发生也可能很少见,还需要进行更多研究来调查这种可能性。
综上,结果表明,在小鼠模型中,家族性阿尔茨海默病可以通过骨髓移植转移,结果暗示阿尔茨海默病是一种全身性疾病,源自大脑外的淀粉样蛋白会导致中枢神经系统病理学。
论文链接:
https://doi.org/10.1016/j.stemcr.2024.02.012
https://doi.org/10.1038/s41591-023-02729-2
版权声明:本文来源于医诺维,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。















