第5篇正刊!南京大学石云教授最新成果登《Nature》
 2021-09-24
2021-09-24
 11583
11583

9月23日,南京大学石云课题组&中国科学院生物物理研究所张凯&赵岩课题组作为共同通讯作者在全球顶级科研期刊《Nature》杂志发表了题为“Kainate receptor modulation by NETO2”的研究论文。
研究团队发现 NETO2 仅接近红藻氨酸受体的两个广泛面,分子间交联 ATDA/C 的下叶、LBDB/D 的上叶和 LBDA/C 的下叶,说明 NETO2 如何调节受体门控动力学。NETO2 的跨膜螺旋位于选择性过滤器的近端,并与 M4 之后的两亲性 H1 螺旋竞争,与受体的 M1-M2 接头形成的细胞内帽结构域相互作用,揭示了NETO2是如何调控纠错的。
据悉,这是南京大学2021年度第5篇正刊,也是南京大学首篇来自“冷冻电镜”领域的科研论文。

红藻氨酸受体 (KAR) 是一类离子型谷氨酸受体,由神经递质谷氨酸激活。它们不仅位于突触后以介导许多大脑区域的兴奋性神经传递,而且还出现在突触前以调节兴奋性和抑制性突触上的递质释放。NETO 蛋白是单程跨膜蛋白,其胞外结构域包含两个 C1r/C1s–Uegf–BMP 结构域(称为 CUB1 和 CUB2)和一个低密度脂蛋白 A 类结构域 (LDLa)。这些蛋白质已被确定为天然 KAR 的辅助成分,并显著影响 KAR 运输、门控和药理学。
更具体地说,NETO2 通过减缓失活和脱敏、加速脱敏恢复和减弱钙渗透性 KAR 的多胺阻断来调节 KAR 门控。尽管最近在分离 KARs的结构研究方面取得了进展,但 NETO 蛋白调节作用的分子基础仍不清楚。
在这里,该研究展示了拮抗剂结合闭合状态和激动剂结合脱敏状态下 GluK2-NETO2 复合物的结构,说明了 GluK2 和 NETO2 之间的相互作用和化学计量,以及 NETO2 对 GluK2 受体门控和孔特性的调节机制。此外,该研究的结构中提供了更完整的孔域,包括选择性过滤器的详细结构。
图文赏析
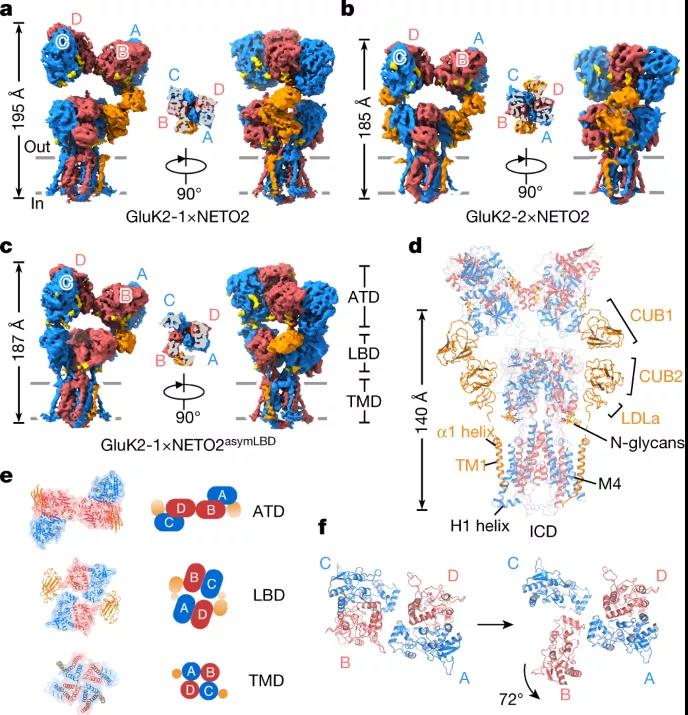
图1 GluK2-NETO2配合物的结构
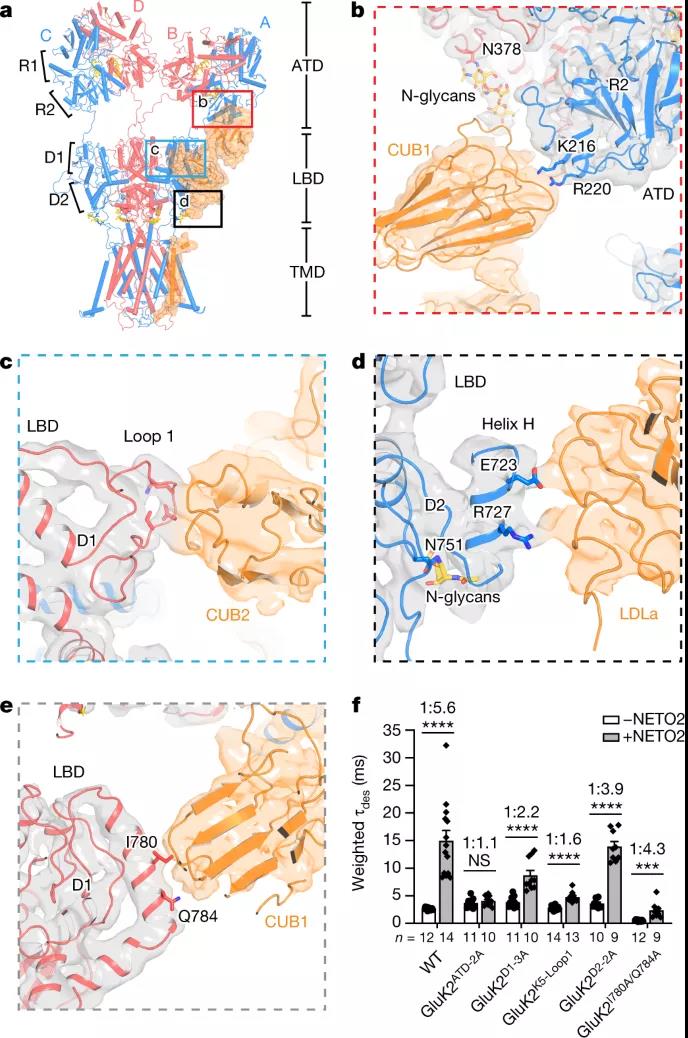
图2 GluK2与NETO2的胞外相互作用
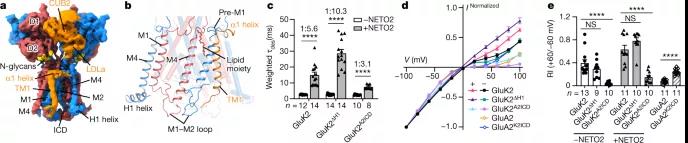
图3 GluK2的离子导电孔及内整流的调制机制
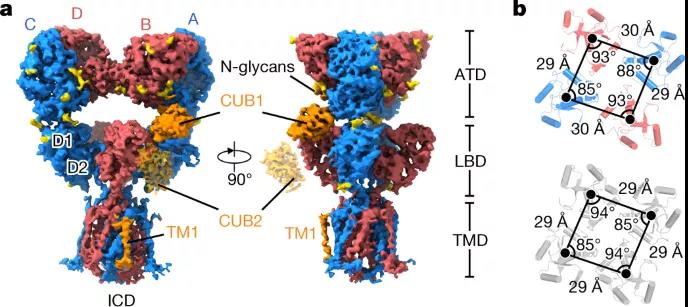
图4 脱敏的GluK2-NETO2配合物的结构
个人简介

版权声明:文章来源Nature、南京大学模式动物研究所,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
















