北京大学合作最新Cell
 2025-07-16
2025-07-16
 7160
7160

iNature
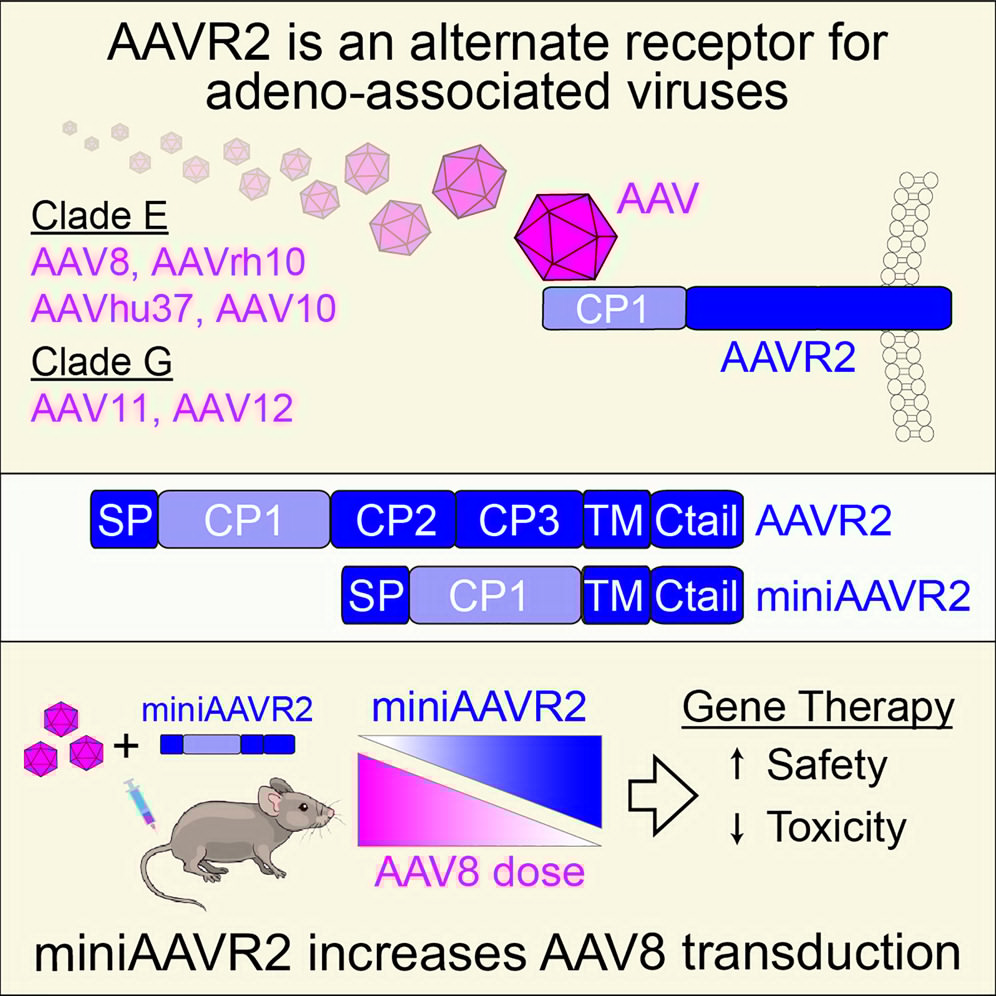
2025年7月14日,北京大学苏晓东、悉尼大学Charles G. Bailey、John E.J. Rasko共同通讯在Cell在线发表题为“An alternate receptor for adeno-associated viruses”的研究论文,该研究报道了 AAV 的另一种受体(AAVR2,羧肽酶D[CPD]),它与多血清型AAV 受体(AAVR)不同。
AAVR2能够转导进化枝E AAVs,包括 AAV8,并确定AAV11和 AAV12的独家AAVR非依赖性转导通路。通过冷冻电子显微镜(cryo-EM)表征了AAV8衣壳与AAVR2之间的直接结合,并鉴定了接触残基。研究人员观察到AAV8通过其可变区VIII直接与AAVR2的羧肽酶样结构域 1结合,并证明缺乏AAVR2结合的AAV衣壳可以被生物工程改造以与 AAVR2结合。最后,过表达最小功能性AAVR2以增强体内AAV转导。该研究提供了对AAV生物学和临床可部署解决方案的见解,以减少与AAV载体相关的剂量相关毒性。

基于腺相关病毒(AAV)的载体被批准用于主流医学,用于治疗色素性视网膜炎、脊髓性肌萎缩症、杜氏肌营养不良症和血友病等疾病。这些人类基因疗法的临床成功取决于AAV安全有效地转导一系列组织的能力。然而,剂量相关的毒性甚至死亡,以及高剂量相关的转基因表达显著减弱,促使人们更加深入理解AAV与宿主的相互作用的分子机制。
目前,腺相关病毒(AAV)的血清型可根据其衣壳的氨基酸序列和结构分为六个分支(A 至 F)。由于不同的血清型表现出不同的细胞/组织嗜性,因此可以靶向不同的组织/疾病群。AAV不同血清型的一个主要区别在于其衣壳与宿主蛋白(包括调控转导和组织嗜性的受体)的亲和力。例如,AAV8是一种广泛用于人类基因治疗的载体,其结构与最早发现的血清型 AAV2相似度达94%,但在免疫原性、受体结合和组织嗜性方面存在差异。
机理模式图(图源自Cell)
早期研究将蛋白聚糖确定为“主要受体”,因为它们在AAV的初始细胞表面结合中发挥作用。这些低亲和力相互作用包括AAV2的硫酸乙酰肝素蛋白多糖;AAV1、AAV4、AAV5 和 AAV6 的唾液酸;和AAV9的半乳糖。然而,现在人们了解到AAV的嗜性和特异性需要高亲和力的蛋白质相互作用。多血清型AAV 受体(AAVR)或 KIAA0319L是一种高尔基体驻留的I型跨膜蛋白,对于大多数天然和生物工程AAV血清型的转导至关重要。然而,已有报道称其他受体和宿主因子表现出血清型或细胞型特异性,AAVR非依赖性途径和血清型。因此,鉴定AAVR非依赖性途径对于改进AAV基因治疗至关重要。
该研究发现了一种腺相关病毒(AAV)的替代受体—AAVR2(CPD),其在缺乏AAVR的情况下,可恢复E分支AAV(包括 AAV8)的转导作用,并为未分类的AAV11和AAV12提供了一条独立于AAVR的专属进入通道。此外,研究团队过表达了一个最小的功能性AAVR2(miniAAVR2)以增强体内 AAV 转导,从而使低剂量的 AAV 也能达到相似的疗效。总的来说,这项研究为AAV生物学提供了新见解,并为减少与AAV载体相关的剂量相关毒性提供了临床可应用的解决方案。
https://www.cell.com/cell/fulltext/S0092-8674(25)00692-0















