iNature
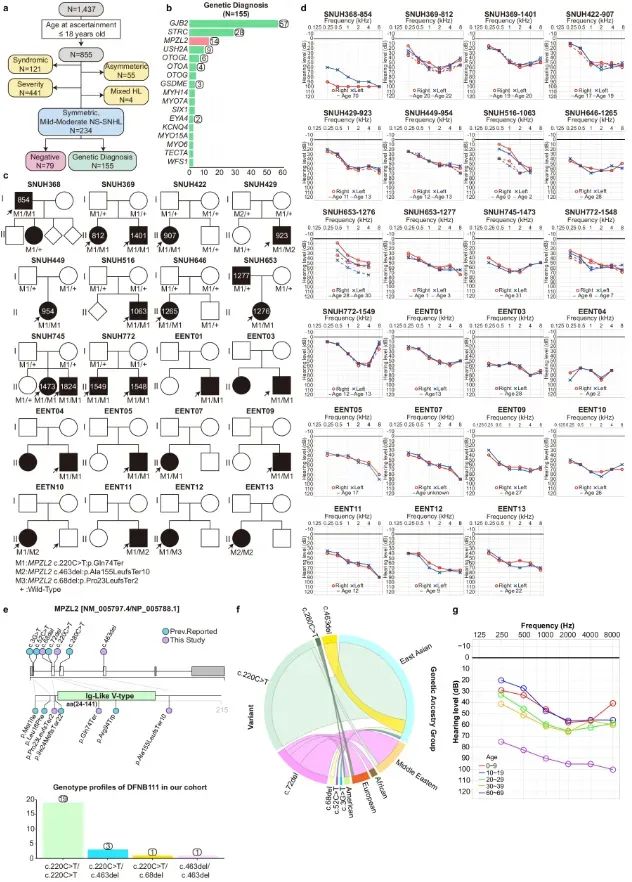
听力损失是最常见的感觉障碍之一,但目前尚无商业化的生物疗法。2025年8月5日,复旦大学舒易来唯一通讯在Nature Communications在线发表题为“PAM-flexible adenine base editing rescues hearing loss in a humanized MPZL2 mouse model harboring an East Asian founder mutation”的研究论文。该研究发现了一种东亚特有的创始突变,即 MPZL2 基因中 c.220 C > T 的纯合突变,该突变在我们的队列研究中导致了相当一部分遗传性耳聋病例。研究发现,这种致病突变可以被腺嘌呤碱基编辑器 (ABE) 靶向,从而实现 AT 到 GC 的碱基校正,而无需造成 DNA 双链断裂。为了证明这一点,研究人员构建了一种人源化小鼠模型 (hMPZL2Q74X/Q74X),该模型可重现人类 MPZL2 耳聋并导致进行性听力损失。一种可适应PAM的ABE变体(ABE8eWQ-SpRY:sgRNA3)可降低旁观者和脱靶效应,并被包装在双腺相关病毒(AAV)中,注射到hMPZL2Q74X/Q74X小鼠的内耳中,从而有效地纠正了突变。该疗法显著恢复了听力功能,改善了内耳结构完整性,并逆转了改变的基因表达。碱基编辑可能对遗传性耳聋(包括大多数MPZL2耳聋病例)具有治疗潜力。
听力损失是人类最常见的感觉障碍,全球约有4.66亿人受到影响。尽管目前尚无治疗方法能够完全恢复生物性听力功能,但随着我们对听力损失遗传结构和分子机制理解的不断深入,内耳基因治疗取得了显著进展。值得注意的是,CRISPR基因组编辑技术已被用于直接修复致病突变,从而为遗传性疾病的根本治疗提供基础。特别是碱基编辑器,包括胞嘧啶碱基编辑器(CBE)和腺嘌呤碱基编辑器(ABE),是经过工程改造的基因组编辑工具,能够精确修复目标基因组碱基对,且不会造成双链断裂。目前,ABE和CBE已成功用于治疗遗传性耳聋小鼠模型中的听力损失,这表明碱基编辑器有望成为由致病性点突变引起的遗传性耳聋的一次性治疗方法。隐性功能丧失突变约占遗传性耳聋病例的80%。其中一种非综合征性常染色体隐性耳聋-111 (DFNB111) 是导致轻度至中度进行性听力损失的主要原因。在本文中,发现了东亚特有的 DFNB111 创始突变,即 MPZL2 中的纯合 c.220 C > T 变体,它导致了我们队列研究中相当一部分遗传性耳聋病例。为了模拟 DFNB111,研究人员生成了可复制人类状况的人源化 MPZL2 c.220 C > T 敲入小鼠模型。对于体内编辑,测试了各种 ABE 变体组合、四种具有不同 PAM 的 Cas9 变体以及单向导 RNA (sgRNA),以纠正 c.220 C > T 突变。最终,本研究确定了最佳的PAM-柔性ABE变体(即ABE8eWQ-SpRY:sgRNA3),其体外编辑效率达到60%,且无可检测的旁观者效应或脱靶效应。将包装在双AAV-ie载体中的ABE8eWQ-SpRY:sgRNA3注射到内耳,成功恢复了听觉功能和内耳的结构完整性。人源化小鼠模型的建立以及使用单个PAM-柔性ABE成功校正MPZL2创始突变,共同代表了碱基编辑基因治疗的重大进展,预示着其在治疗遗传性耳聋(包括大多数DFNB111病例)方面具有巨大的潜力。图1 MPZL2 c.220 C > T 突变的临床意义(图源自Nature Communications)
https://www.nature.com/articles/s41467-025-62562-8
 2025-08-07
2025-08-07
 5379
5379