iNature
声光动力疗法(SPDT)融合了声动力疗法(SDT)和光动力疗法(PDT)的优点,在恶性肿瘤的微创治疗中显示出巨大潜力。然而,致敏剂在PDT中的有效性往往受到光穿透不足的影响,限制了SPDT的协同治疗效果。2025年7月16日,清华大学刘凯、解放军总医院苗莉、中国科学院大学苏娟娟共同通讯在ACS Nano在线发表题为“In Situ Ultrasound-Triggered Bioluminescence for Combined Sono/Photodynamic Immunotherapy”的研究论文。该研究提出了一种原位超声触发生物发光来增强SPDT的可控策略。
该方法利用由大电导(MscL)机械敏感通道和水苷光蛋白(AEQ)组成的机械敏感生物发光蛋白。在超声刺激下,MscL通过诱导Ca2+内流来响应机械力,随后激活AEQ氧化致光底物并产生生物发光。利用超声及其相关的生物发光,天然声光敏剂氯e6(Ce6)表现出有效的声/光细胞毒性,诱导免疫原性细胞死亡,并协同增强抗肿瘤免疫应答。超声触发的SPDT不仅可以抑制原发肿瘤的生长和转移,还诱导长期免疫记忆来抑制肿瘤复发。SPDT与免疫激活的结合形成了原位乳腺癌治疗的多模式“声光免疫”平台,同时防止肿瘤切除后复发,为增强癌症治疗效果开发了一种通用工具。
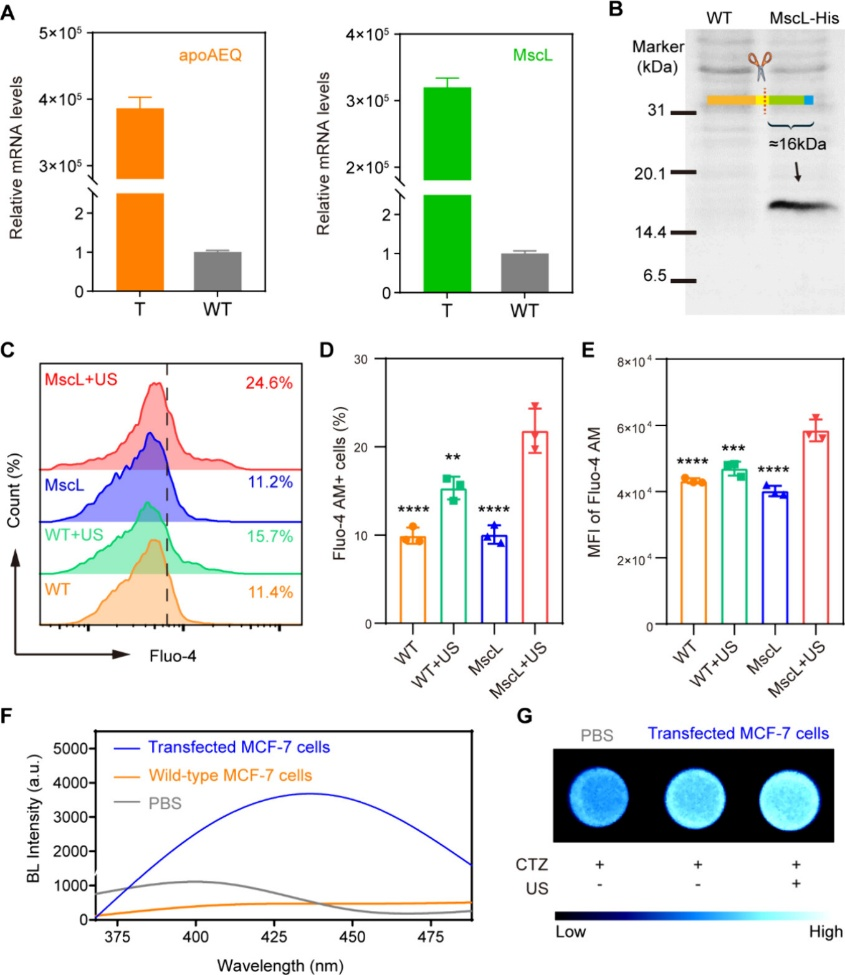
光动力疗法(PDT)和声动力疗法(SDT)是一种无创癌症疗法,利用特定光波长或超声波激活致敏剂,产生活性氧(ROS),诱导肿瘤氧化损伤并刺激抗肿瘤免疫。与传统的癌症治疗相比,此类方法特异性地在肿瘤组织内积累致敏剂以进行靶向激活,最大限度地减少对周围正常组织的损害和全身副作用。血卟啉、氯e6(Ce6)、玫瑰红和吲哚菁绿等致敏剂作为SDT和PDT的重要组成部分,都表现出声动力学和光动力学活性。因此,声光动力疗法(SPDT)已作为一种联合疗法,同时使用光和超声波激活致敏剂。这种双重激活可以产生协同治疗效果,增强肿瘤细胞的消除,同时减少致敏剂的所需剂量,从而最大限度地减少副作用。然而,紫外可见光照射固有的组织损伤和光穿透等问题,使得SPDT难以有效激活深部肿瘤区域的致敏剂。因此,设计可替代的SPDT致敏剂具有重要意义。近期研究强调了超声波触发体内发光的潜力,有效解决了外部光激发的局限性。有学者报道了声余辉纳米颗粒,其包含一种超声敏化剂,能够在超声刺激下产生单线态氧(1O2)。这种激活导致余辉发光,专为肿瘤靶向治疗诊断学量身定制。类似的策略包括压电响应发光纳米粒子,通过压电效应将超声波的机械波动转化为化学能,从而诱导化学发光。在此基础上,作者假设超声诱导发光(USL)可以解决光穿透的固有限制,增强SPDT,同时利用超声控制发光。然而,由于化学发光底物的ROS清除作用,所有报道的依赖化学发光的USL方法都可能影响癌症治疗。此外,传统的USL信号强度较弱、实时性差、空间分辨率有限,限制了其广泛应用。因此,制定有效的原位USL策略对SPDT的发展具有重要意义。图1 机械响应生物发光蛋白的表征(摘自ACS Nano )该研究提出了一种用于SPDT癌症治疗的新型原位超声触发生物发光策略。该方法利用特殊设计的机械响应生物发光蛋白,包括大电导机械敏感通道(MscL)和水苷光蛋白(AEQ)。超声触发蛋白的原位生物发光,从而增强Ce6的声学/光毒性。此外,声致生物发光纳米颗粒(SNLP)递送底物腔肠素400a(CTZ)和致敏剂Ce6,增强超声触发生物发光的体内调控和应用。通过超声激活的Ce6及其产生的生物发光协同增强抗肿瘤免疫反应,凸显了该方法在癌症“声-光-免疫”治疗模式中的有效性。
https://pubs.acs.org/doi/10.1021/acsnano.5c06999
 2025-07-31
2025-07-31
 5920
5920