Cell 子刊:哈尔滨工业大学黄志伟团队发表免疫机制重要研究成果
 2025-05-21
2025-05-21
 5282
5282

5 月 6 日,生命科学和医学学部/生命科学中心黄志伟教授团队在《免疫学》(Immunity)发表题为《磷酸抗原通过由内而外稳定嗜乳脂蛋白受体复合物驱动二聚化依赖性 γδ TCR 活化》(Phosphoantigen-induced inside-out stabilization of butyrophilin receptor complexes drives dimerization-dependent γδ TCR activation)的研究论文。

该研究通过解析磷酸抗原结合状态下嗜乳脂蛋白家族受体(BTN)和 BTN-γδ TCR 复合物的高分辨三维结构以及生化实验,揭示了 BTN 家族复合物的组装和活性调控,以及配体诱导的 BTN 由内而外传导信号激活 γδ TCR 的分子机制,为开发靶向 γδ T 细胞的新型免疫疗法提供精确的结构模板和理论指导,对自身免疫疾病以及对肿瘤疾病的治疗具有重要意义。
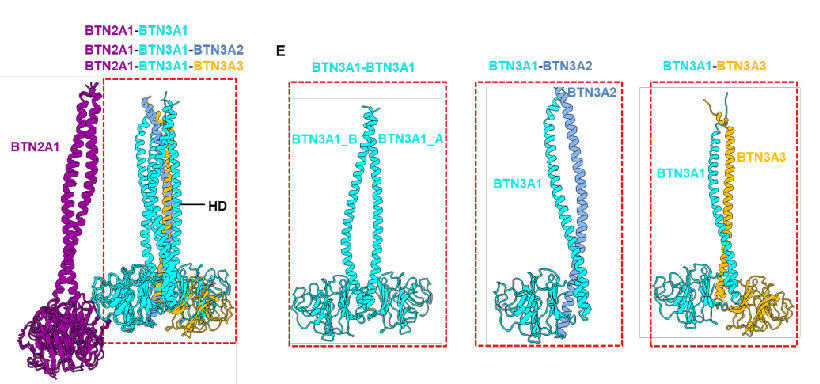
3A1-3A2/3A3 异源二聚体显示出比 3A1 同源二聚体更稳定的结构
γδ T 细胞是 T 细胞的一个独特亚群,因其 T 细胞受体(TCR)由 γ 链和 δ 链组成而得名。与常见的 αβ T 细胞不同,γδ T 细胞具有独特的发育途径、组织分布和免疫功能,在免疫防御、组织稳态和疾病中发挥重要作用。表达 γδ 型 TCR,多样性低于 αβ TCR,但能直接识别病原体或应激相关分子(如磷酸抗原、热休克蛋白),且无需 MHC 呈递。
其中,Vγ9Vδ2 亚群作为 γδ T 细胞中占比最多的一类亚群,通过 Vγ9Vδ2 TCR 识别肿瘤和微生物产生的胞内磷酸抗原(pAg)诱导组装嗜乳脂蛋白(Butyrophilin,BTN)受体复合物(包括 BTN2A1、BTN3A1、BTN3A2 和 BTN3A)激活免疫反应,这种「由内而外(inside-out)」的免疫激活是 Vγ9Vδ2 T 细胞亚群所特有的。研究表明,BTN 家族蛋白通过胞内 B30.2 结构域感知 pAg 并通过其胞外 IgV 结构域募集,并激活 Vγ9Vδ2 T 细胞。由于缺乏完整的 BTN 和磷酸抗原诱导的 BTN 与 Vγ9Vδ2 TCR 复合体的结构数据,肿瘤等细胞胞内 pAg 信号如何通过 BTN 复合物由胞内传递至胞外并激活 Vγ9Vδ2 TCR 的分子机制尚未可知。
在该研究中,团队首先解析磷酸抗原 HMBPP(4-羟基-3-甲基-2-烯基焦磷酸)结合状态下 3 种 BTN 家族蛋白复合物(BTN2A1-BTN3A1,BTN2A1-BTN3A1-BTN3A2,BTN2A1-BTN3A1-BTN3A3)的高分辨冷冻电镜结构,在磷酸抗原 HMBPP 结合状态下,BTN2A1 与 BTN3A1 以 2:2 的化学计量比形成四聚体结构;而 BTN2A1-BTN3A1-BTN3A2/BTN3A3 复合物则形成 2:1:1 的四聚体结构。团队通过结构比较发现,BTN3A1-BTN3A2/BTN3A3 异源二聚体中的螺旋束(HDs)形成了比 BTN3A1 同源二聚体更稳定的结构。这种增强的结构稳定性解释了 BTN3A1-BTN3A2/BTN3A3 异源二聚体为何比 BTN3A1 同源二聚体激活 T 细胞能力更强。
所以,BTN3A2 和 BTN3A3 本质上承担着 BTN3A1 受体活性的调控功能,尽管 BTN3A2 和 BTN3A3 不能直接结合 pAg,但通过结构协同作用增强了 BTN 复合物介导的免疫应答。这一发现为理解 BTN 复合物激活、调控 γδ T 细胞活性提供了新视角。
为阐明 Vγ9Vδ2 TCR 识别 BTN 的分子机制,团队解析了 HMBPP-BTN2A1-BTN3A1-BTN3A2-Vγ9Vδ2 TCR 复合物的冷冻电镜结构,发现磷酸抗原 HMBPP-BTN 复合物引起了 Vγ9Vδ2 TCR 的二聚化:其中一个 Vγ9Vδ2 TCR 胞外结构域被「夹」在 BTN2A1 与 BTN3A2 的 IgV 结构域之间,另一个 Vγ9Vδ2 TCR 胞外结构域与游离的 BTN2A1 IgV 结构域相互作用。
这种识别机制显著区别于经典 αβ TCR 以 1:1 化学计量比识别 MHC-抗原复合物的经典模式,揭示了 Vγ9Vδ2 T 细胞独特的免疫激活机制。该机制不仅显著提高了抗原信号敏感性,还赋予了 γδ T 细胞快速抗原响应的能力,反映了其在进化过程中为应对肿瘤和感染压力而进化出的特殊适应性。
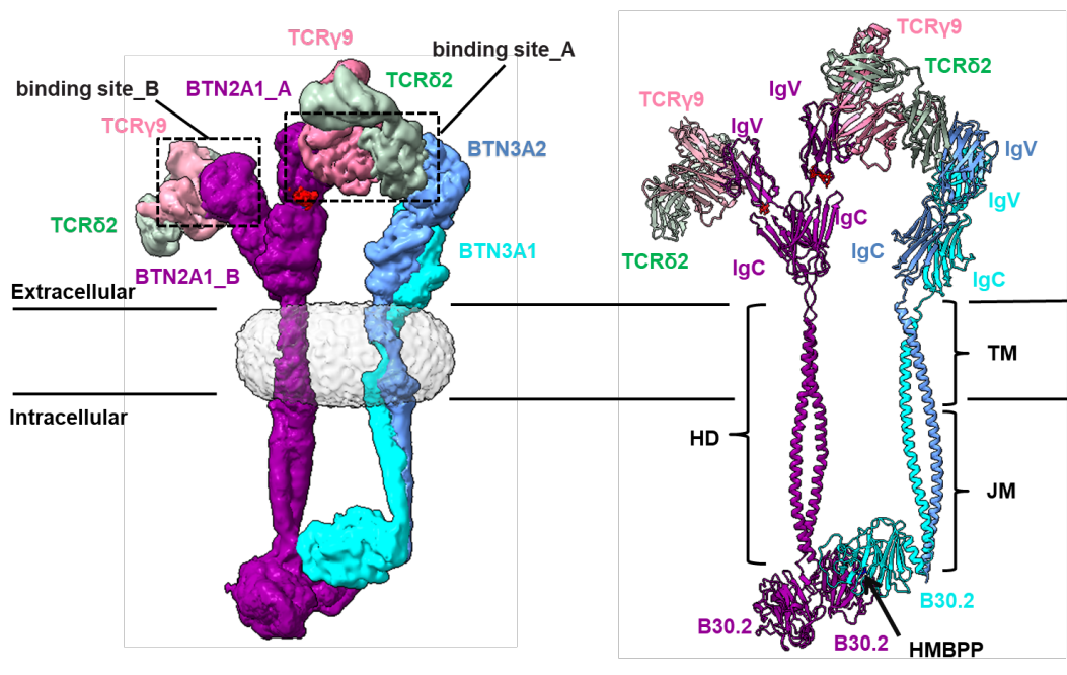
BTN 复合物诱导 Vγ9Vδ2 TCR 二聚化
生命科学和医学学部/生命科学中心黄志伟教授为论文通讯作者,团队副研究员朱玉威,博士生高文博、郑建林、白叶、田昕雨、黄滕锦为论文共同第一作者。该研究获国家重点研发计划、国家自然科学基金、腾讯新基石科学基金的资助。
















