程柯团队,Nature Biotechnology!
 2026-01-07
2026-01-07
 10152
10152


免疫检查点抑制剂曾被视作晚期黑色素瘤治疗的重要突破,然而约40%的患者对该疗法不敏感,且全身性给药常伴随严重免疫相关不良反应,包括肝炎、肾功能损伤及自身免疫性糖尿病等多器官毒性反应。若能实现肿瘤局部特异性给药,并同步阻断抑制T细胞功能的关键点,将有望突破现有免疫治疗瓶颈。
成果简介
哥伦比亚大学生物医学工程系程柯教授团队最新研发的双特异性外泌体平台BEAT(Bispecific Exosome Activator of T cell)为此提供了创新解决方案。该平台通过工程化改造天然外泌体,使其表面高效共表达PD-1与FZD8关键结构域,形成兼具PD-L1结合与Wnt信号拦截功能的双特异性纳米载体。经吸入给药后,BEAT可特异性靶向肺转移性黑色素瘤,通过局部免疫微环境重编程促进CD8⁺ T细胞浸润与活化。
该平台的创新点在于三个方面:首先,通过工程化改造实现外泌体表面双受体的高效共表达;其次,采用吸入给药实现肺部特异性富集;最后,基于临床耐药机制设计合理的靶点组合。

图|双特异性外泌体平台BEAT工作模式图
在外泌体工程化方面,研究团队系统比较了多种外泌体分选结构域,包括CD9、CD81、Alix和Syntenin。以信号缺陷型PD-1为模型蛋白的研究发现,基于Alix分选结构域的构建体表现最优。Western blot分析显示,PD1-Alix融合蛋白在外泌体中的富集效率最高。冷冻电镜观察显示PD-1在外泌体表面形成致密均匀的冠状分布。团队用 Alix 作为分选模块,将工程化外泌体蛋白展示效率在现有研究水平上进一步提升,并率先实现了双蛋白的高效、等比例同步锚定。
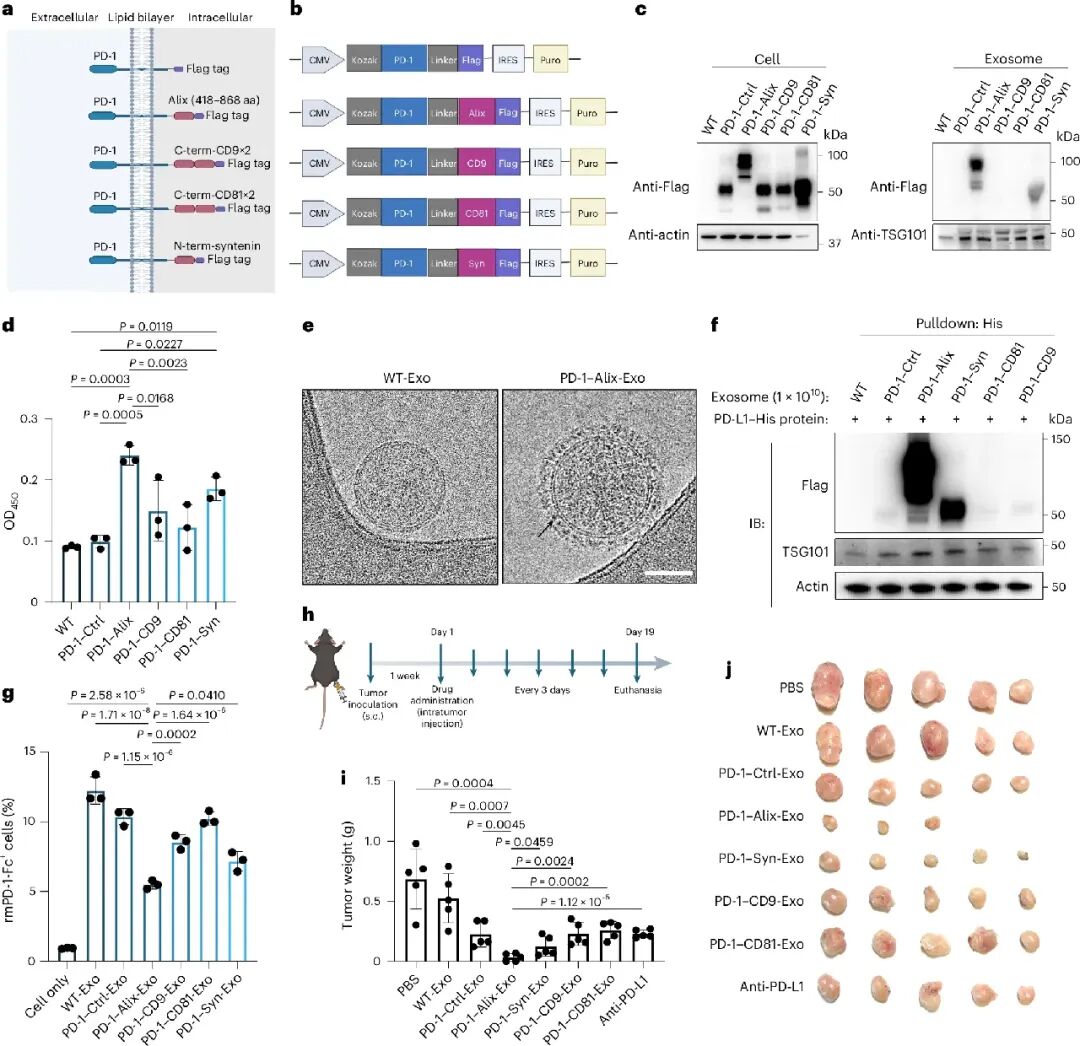
在递送策略方面,研究团队采用吸入给药方式。药代动力学研究显示,PD1-Alix-Exo在吸入后24-48小时内主要富集于肺部,在肝、肾等非靶器官的分布显著低于系统给药的抗PD-L1抗体。在肺定植黑色素瘤模型中,吸入PD1-Alix-Exo表现出显著的抗肿瘤效果,其疗效优于吸入给药的抗PD-L1抗体、PD1蛋白,甚至优于系统给药的抗PD-L1抗体。

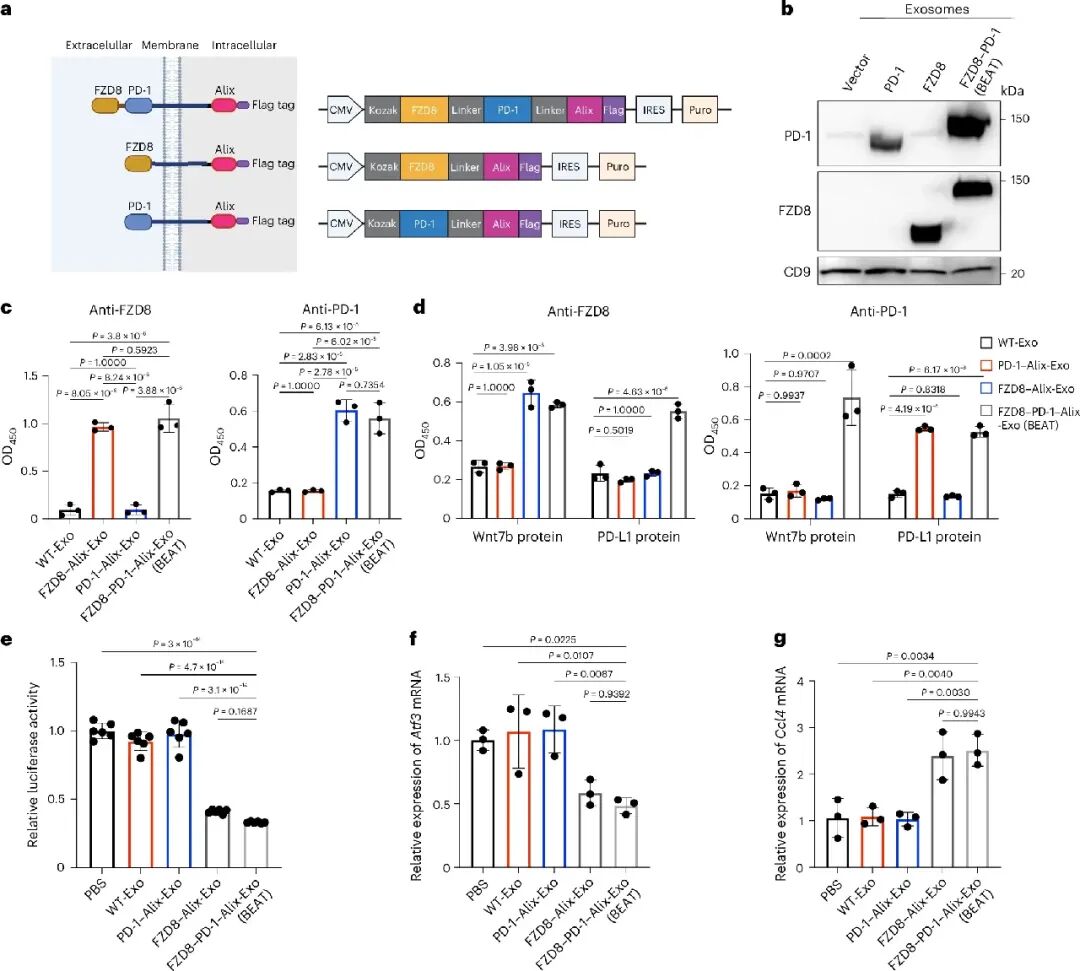
在靶点选择上,团队通过对免疫检查点抑制剂耐药患者转录组数据(GEO: GSE78220)的再分析发现,Wnt信号通路中Wnt7b和FZD8在非应答者中显著上调。进一步的机制研究通过pull-down实验证实Wnt7b与FZD8直接结合,TCF/LEF双荧光素酶报告基因检测显示FZD8是Wnt7b激活β-catenin信号的关键受体。基于这些发现,团队构建了双特异性外泌体BEAT,利用Alix分选域将FZD8的Wnt7b结合CDR结构域与信号缺陷型PD-1串联融合,实现在同一外泌体表面的共表达。ELISA和pull-down实验证实BEAT能同时结合PD-L1和Wnt7b,超分辨显微镜观察显示两种受体在单个外泌体表面共定位。功能实验表明,BEAT能有效抑制Wnt/β-catenin信号通路,降低Atf3转录水平,上调Ccl4表达。
为了进一步模拟临床环境,团队建立了人源化免疫系统小鼠模型,使用三位健康供者的CD34+细胞重建人类免疫系统,并采用对帕博利珠单抗耐药的患者来源黑色素瘤建立PDX模型。研究结果显示,在两位供者来源的人源化小鼠中,BEAT实现了肿瘤完全消退,第三位供者的小鼠中也观察到肿瘤生长显著抑制。值得注意的是,在所有三组人源化小鼠中,帕博利珠单抗均未能有效控制肿瘤生长。在肺定植模型中,吸入BEAT同样表现出优于帕博利珠单抗的抗肿瘤活性。
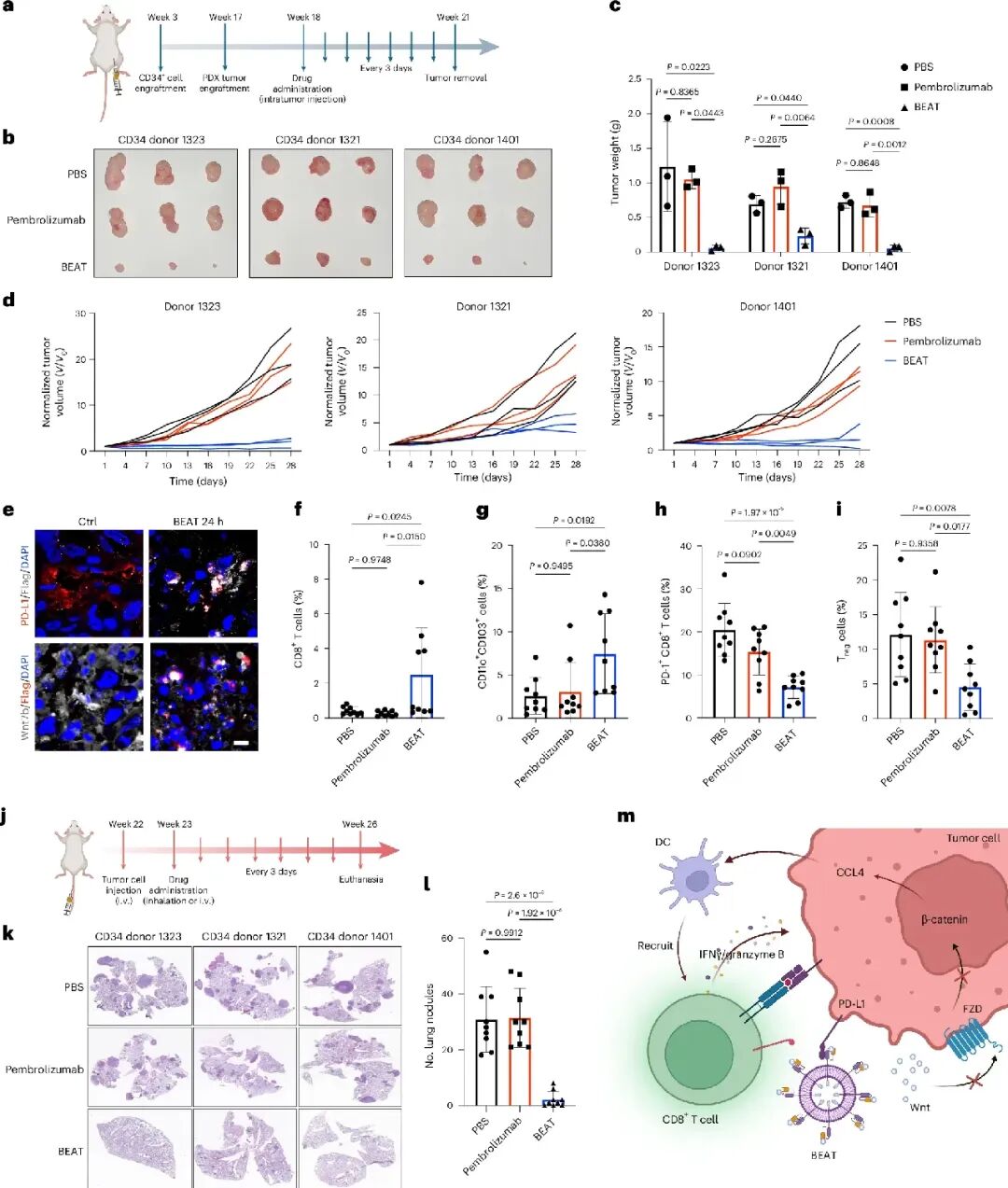
安全性评估显示,吸入BEAT不会引起肝肾功能异常,血清AST、ALT、尿素氮和肌酐水平均在生理范围内。组织病理学检查未见主要器官的明显病变。相比之下,系统给予抗PD-L1抗体的小鼠出现血糖升高和AST水平上升,提示可能发生了自身免疫性糖尿病和肝损伤。
小结
该技术路径的核心创新在于构建了从分选系统优化、双特异性构建、机制创新到递送策略的全程工程技术体系。该BEAT平台不仅展示了克服免疫治疗耐药性的突破性潜力,更重要的是提供了一个从靶点发现、载体构建到递送策略的完整技术范式,为基于工程化外泌体的肿瘤免疫治疗开辟了新的研究方向。
参考文献
Liu, S., Liu, M., Wang, Z. et al. Engineering bispecific exosome activators of T cells to target immune checkpoint inhibitor-resistant metastatic melanoma. Nat Biotechnol (2026).
https://doi.org/10.1038/s41587-025-02890-8
















