南方科技大学, 最新Science子刊!
 2025-06-18
2025-06-18
 6531
6531

α-手性磷化合物是一类重要的有机催化剂和配体,因其在有机合成、药物开发及材料科学等领域中的广泛应用而备受关注。与传统的磷配体材料相比,α-手性磷化合物在催化选择性、分子识别和手性诱导等方面具有显著优势。然而,由于其分子结构中Csp³–Csp³键的构建涉及空间位阻大、立体控制难度高等问题,目前高效、对映选择性构建该类结构仍面临诸多挑战,限制了其进一步发展和广泛应用。
为克服这一根本性问题,南方科技大学舒伟团队和澳门大学陈美婉等人携手在Science Advances期刊上发表了题为“Asymmetric alkyl-alkyl coupling between electron-deficient and unactivated alkenes to access α-chiral phosphines by Ni catalysis”的最新论文。
该团队设计并实现了一种镍催化的不对称交叉氢二聚反应,首次成功地将电子缺陷型烯基膦硫化物与非活化烯烃偶联,构建了α-手性磷化合物。这项工作开辟了不依赖传统烷基亲电或亲核试剂,而是直接以两种结构简单、来源丰富的烯烃作为前体实现Csp³–Csp³键形成的新路径。研究中,科学家通过精准调控反应体系的化学选择性、区域选择性和对映选择性,使得该反应不仅能在温和条件下顺利进行,还表现出良好的底物兼容性,适用于多种官能团修饰的底物。
此外,该研究还进一步探讨了反应机理,并结合合成应用验证了该策略的实用性,展现出其在构建复杂手性有机分子中的巨大潜力。该成果不仅为手性磷化合物的合成提供了高效策略,也为不对称Csp³–Csp³交叉偶联反应的发展提供了新的思路和理论基础。

(1)实验首次实现了电子缺陷型烯烃与非活化烯烃之间的不对称交叉氢二聚反应,成功合成了α-手性膦硫化物。这是首次报道通过两种不同电子性质的烯烃直接构建Csp³–Csp³键,填补了以往仅能获得消旋产物的研究空白。
(2)实验通过镍催化策略,精确调控反应的化学选择性、区域选择性与对映选择性,避免了传统方法中需使用化学计量的烷基亲电体或亲核体的局限性,显著提高了反应的原子经济性和绿色合成效率。
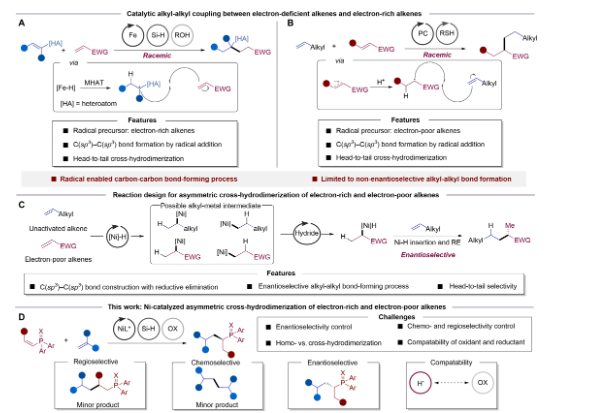
图1. 电子缺陷型烯烃的催化交叉氢二聚反应。
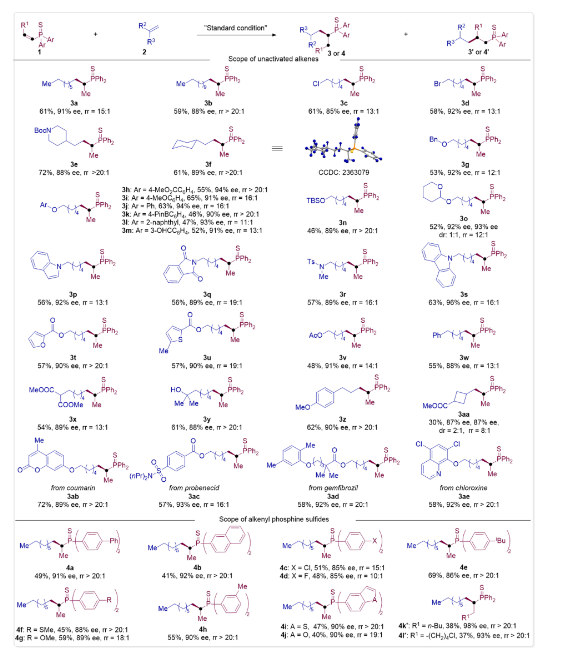
图2. 非活化烯烃和不饱和膦硫化物的底物适用范围。
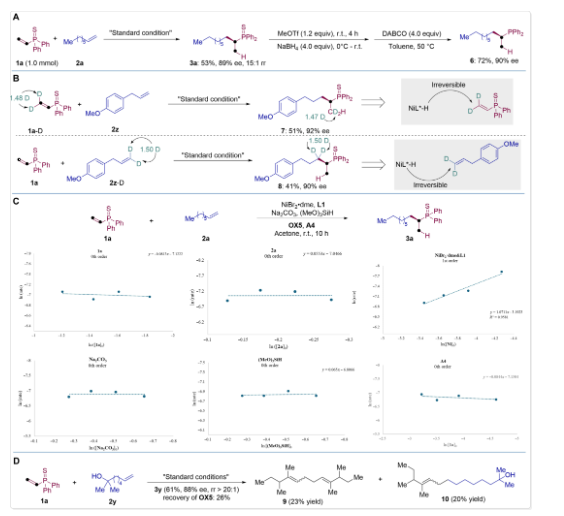
图3. 合成应用与反应机理研究。

图4. 反应的拟议机制。
总之,本文开发了一种镍催化的不对称交叉氢二聚反应方法,可将烯基膦硫化物与非活化烯烃偶联。该反应通过还原-氧化序列,实现了电子中性非活化烯烃与电子缺陷烯烃之间的头-尾式不对称烷基-烷基交叉偶联,成功构建了具有α-手性中心的脂肪族磷化合物,这类化合物以往难以高效获取。反应能够区分电子贫与电子富烯烃,选择性地经历金属氢化与偶联过程,具有良好的区域选择性与对映选择性。
反应成功的关键在于氧化剂与还原剂的兼容性,以及在严格控制化学选择性、区域选择性和对映选择性的前提下实现两种烯烃的顺序组装。此外,该方法在天然产物的后期修饰和手性单膦配体的合成中也展现出良好应用前景,显示出其在有机合成与催化领域的广泛潜力。
Jian-Yu Zou et al. ,Asymmetric alkyl-alkyl coupling between electron-deficient and unactivated alkenes to access α-chiral phosphines by Ni catalysis.Sci. Adv.11,eadv6571(2025).DOI:10.1126/sciadv.adv6571
















