复旦大学,最新Nature!
 2025-06-18
2025-06-18
 6864
6864

近年来,RNA不仅作为信息载体的角色逐渐退居幕后,其作为功能分子的地位在生物学和纳米技术中日益凸显。尤其是长非编码RNA(lncRNA),它们在基因调控、RNA加工及病毒生命周期中都展现出重要功能。然而,相较于蛋白质或短RNA,lncRNA在结构上的认知仍较为欠缺,主要受限于其大尺寸和结构异质性所带来的解析难度。ROOL RNA是一种天然存在于牛瘤胃宏基因组数据中的lncRNA,后来在细菌和噬菌体中被发现,部分菌株中的表达量可与16S rRNA相当。
近期,美国麻省大学Chan医学院方文雯,Andrei A. Korostelev团队和复旦大学生命科学学院的麻锦彪,Xiaobin Ling团队合作,利用冷冻电子显微镜(Cryo-EM)技术,对ROOL RNA的三维结构进行了深入解析。这项研究不仅揭示了ROOL RNA能自组装为中空八聚体纳米笼的惊人能力,还揭示了其装配机制和结构稳定性的分子基础,并展示了它作为RNA递送平台的工程潜力。相关研究成果以Cryo-EM structure of a natural RNA nanocage为题,于2025年5月16日以预印本形式发表于Nature期刊。

【主要内容】
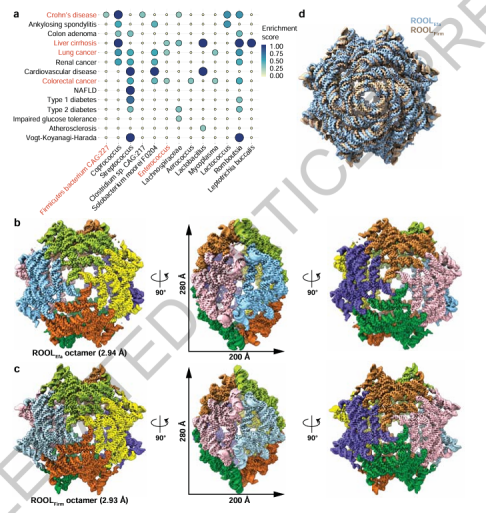
图1:ROOLEfa 和 ROOLFirm 的冷冻电镜分析
作者分别从两种细菌中提取代表性ROOL序列(ROOLEfa和ROOLFirm),借助Cryo-EM重构了它们的三维形态。图1展示的八聚体结构呈现出一种对称、中空的笼状构型,整体尺寸达到纳米级别。令人惊讶的是,即使这两种ROOL RNA在序列上差异显著,它们形成的三维结构却几乎完全重叠。这种高度保守的构象提示:RNA不仅能够形成复杂稳定的空间结构,而且可能具有类似病毒衣壳或细胞器的纳米包封功能。
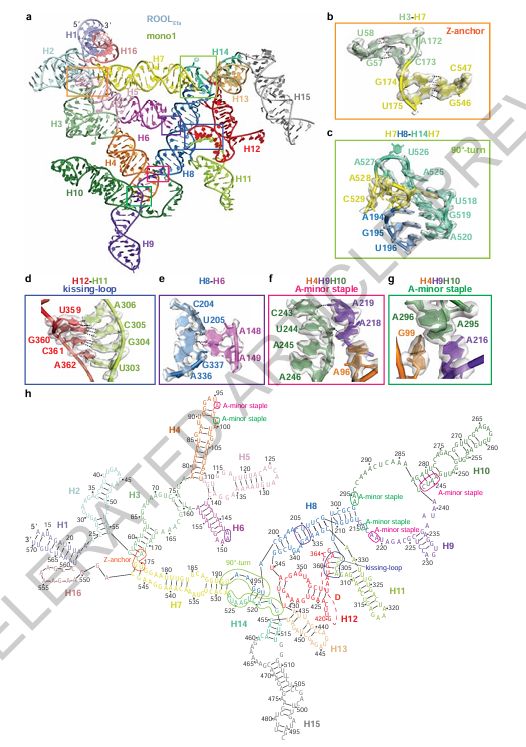
图2:三级结构互作稳定纳米笼中的 ROOLEfa 单体
作者在其中识别出大量经典的RNA互作模式,如“kissing loops”(亲吻环)以及“A-minor interactions”。更重要的是,他们定义了一种全新的三链结构互作模式,命名为“A-minor staples”,这是一种由三股链腺嘌呤互作构成的稳定结构,起到了像“钢筋扣件”一样的作用,使RNA骨架保持弯曲、对接的形态。
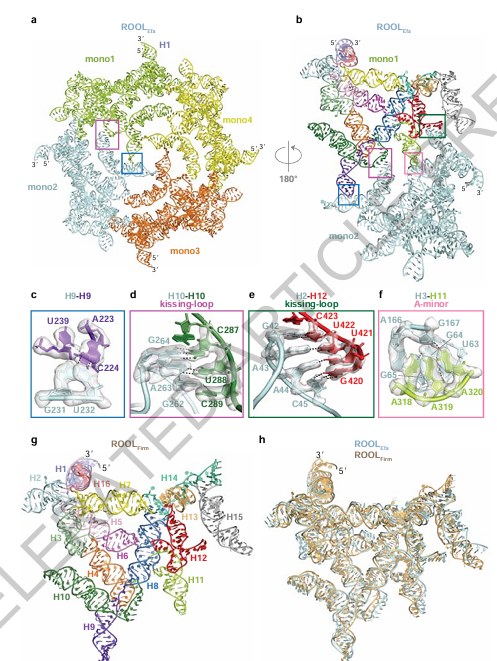
图3:四级结构互作稳定 ROOLEfa 八聚体
图3通过详细展示四聚体和八聚体之间的关系,描述了ROOLEfa RNA分子如何一步步组装成笼状结构的过程。作者指出,八聚体是由两个四聚体通过特定互作拼合而成。拼合界面中,几组kissing loops与A-minor staples在精确的位置“咬合”在一起。这些互作不仅是结构粘合剂,也是“分子识别密码”,确保组装过程中不出现错误连接。此外,通过质谱和层析分析,作者还验证了在溶液中确实存在包括单体、四聚体、八聚体在内的多种装配中间态。

图4:ROOLFirm 变体的分析
作者对ROOLFirm RNA进行了突变实验:他们删除了部分内部可变区域,并在其3’端融合了不同的功能RNA,包括荧光适配体、tRNA前体与miRNA。结果显示,无论是内部剪切还是外源RNA融合,ROOL结构都未受到明显破坏,依旧维持稳定的八聚体结构。更惊喜的是,这些融合RNA在电镜图像中甚至呈现出向外辐射的“货物”分布,仿佛RNA笼正在“展示”它所包裹的内容。
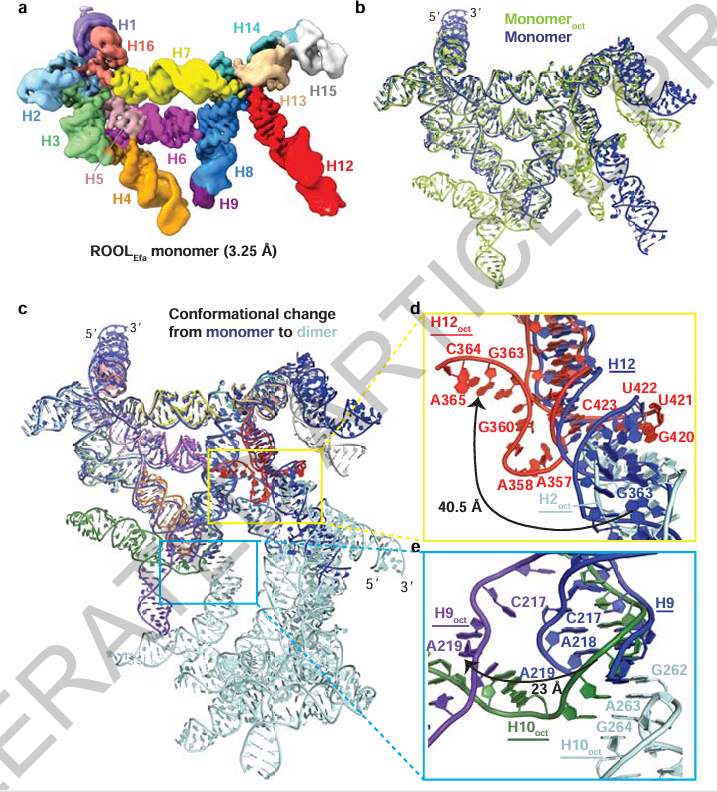
图5:ROOLEfa 单体的结构
作者通过Cryo-EM单粒子分析捕捉到了一种未组装状态下的ROOLEfa单体,并与组装体中的构象进行了对比。结果发现,单体中有两个螺旋区域(H8-H10 和 H12)发生了明显的重排,需要进行“链交换(strand swapping)”以完成组装。这一过程类似于某些蛋白质中的构象变化机制,代表了一种RNA结构动态调控的新方式。作者通过构建突变体进一步验证了这一模型。
【全文总结】
该论文揭示了一种来自细菌和噬菌体基因组中的长非编码RNA(lncRNA)ROOL的天然RNA纳米笼结构。通过约2.9 Å的冷冻电镜解析,发现ROOL RNA形成直径28纳米、轴向长度20纳米的八聚体纳米笼,内部空腔结构松散且通过三股A-小体等多种高级结构相互作用稳定。单体结构分析表明纳米笼的组装依赖链交换机制形成四级结构的吻合环。研究还证明ROOL RNA可携带并呈现融合的功能性RNA货物,展示了其作为RNA纳米载体在生物研究和治疗应用中的潜力。
















