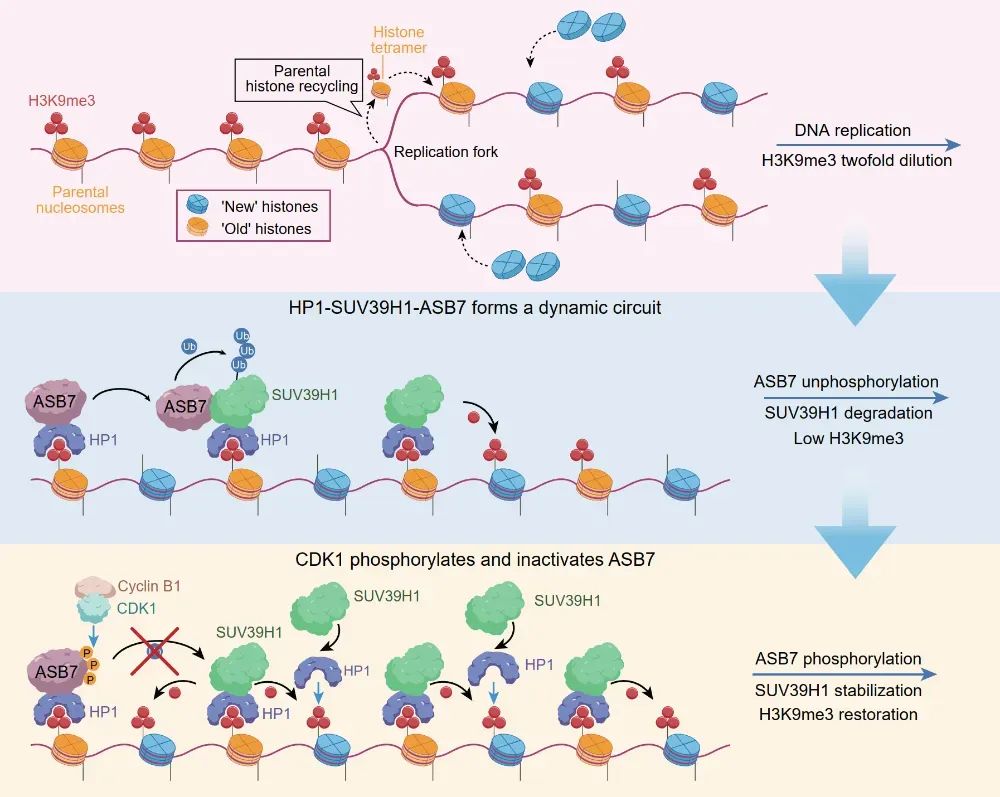
H3K9me3(组蛋白H3第9位赖氨酸三甲基化)是表观遗传学中一种重要的染色质修饰标记,主要通过调控染色质结构和基因表达参与多种生物学过程。SUV39H1 甲基转移酶催化 H3K9me3 的建立,是其写入器(Writer),而组蛋白去甲基化酶(例如 KDM4家族)动态去除 H3K9me3,是其擦除器(Eraser),HP1 则是其阅读器(Reader)。
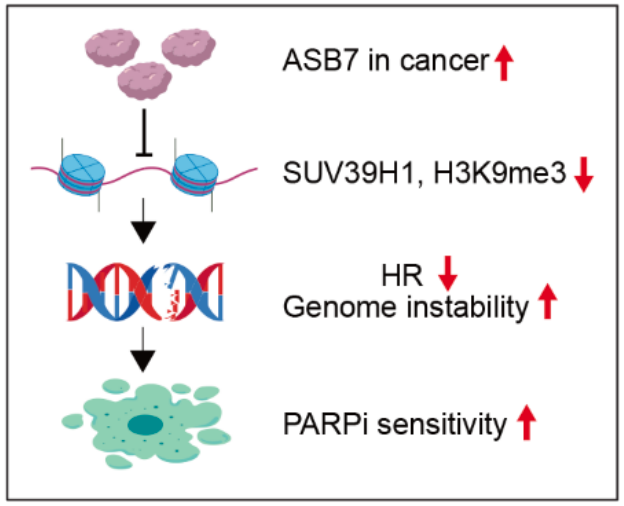
H3K9me3 的表观遗传维持依赖于 HP1 蛋白识别预先存在的甲基化标记,进而招募甲基转移酶 SUV39H1 对邻近新掺入的组蛋白进行甲基化修饰,形成自我强化的“读-写”正反馈环路。然而,这种正反馈如何被限制以实现 H3K9me3 的动态稳态,其分子机制尚不明确。2025 年 5 月 29 日,中山大学肿瘤防治中心康铁邦/武远众团队(周立文、陈振轩、邹叶子为共同第一作者)在国际顶尖学术期刊 Science 上发表了题为:ASB7 is a negative regulator of H3K9me3 homeostasis 的研究论文。该研究表明,E3 泛素连接酶 CUL5ASB7发挥着在 H3K9me3 的动态稳态中发挥着刹车器的作用,通过细胞周期依赖性降解 SUV39H1 来保障 H3K9me3 在细胞周期中精准重建,进而维持异染色质在细胞增殖过程中的结构稳定。在这项最新研究中,研究团队通过全基因组范围的无偏向性 CRISPR-Cas9 筛选,鉴定出 E3泛素连接酶复合体 CUL5ASB7 作为 H3K9me3 的负向调控因子。从机制上来说,HP1 将 ASB7 招募至异染色质区,异染色质定位的 ASB7 可促进 SUV39H1 的泛素化降解,该降解过程受到严密的细胞周期控制。在有丝分裂的 S 期及 G2 期,ASB7 处于非磷酸化状态,可有效结合并降解 SUV39H1,从而限制 H3K9me3 过度修饰及延伸;进入有丝分裂 M 期后,CDK1 激酶磷酸化修饰 ASB7,进而破坏 ASB7 与 SUV39H1 互作,阻断 SUV39H1 蛋白降解,使其在 M 期达到顶峰,促进了 H3K9me3 在 M 期及 G1 期的重建,从而保障了 H3K9me3 在下一个 S 期开始之前精准恢复至初始水平。总的来说,该研究发现在哺乳动物体细胞 DNA 复制后的 H3K9me3 表观遗传过程中,ASB7 发挥了刹车器角色,通过 HP1-SUV39H1-ASB7 介导的“读-写-降解”平衡,控制着 H3K9me3 的稳态,从而确保了精准的表观遗传传递,并防止异染色质过度形成。HP1-SUV39H1-ASB7 介导的“读-写-降解”平衡,调控 H3K9me3 表观遗传H3K9me3 及异染色质稳态失调会导致基因组不稳定,研究团队进一步发现,ASB7 在多种肿瘤中呈扩增状态,ASB7 高表达引起 H3K9me3 水平降低,进而导致同源重组修复受损及基因组不稳定。这一现象提示,ASB7 扩增型肿瘤患者可能是 PARP 抑制剂(PARPi)的潜在获益人群。
https://www.science.org/doi/10.1126/science.adq7408
 2025-06-04
2025-06-04
 5015
5015