重要突破!2024年中山大学苏士成团队迎来首篇Cancer Cell
 2024-05-31
2024-05-31
 6545
6545
肿瘤采用各种策略来逃避免疫监视。中枢神经系统(CNS)具有多种抑制免疫反应的功能。肿瘤和中枢神经系统是否有相似的免疫抑制机制尚不清楚。
2024年5月30日,中山大学苏士成团队在Cancer Cell 在线发表题为“Tumor cells impair immunological synapse formation via central nervous system-enriched metabolite”的研究论文,该研究分析了接受曲妥珠单抗和抗PD- L1抗体治疗的HER2+ 乳腺癌患者肿瘤的多组学数据,发现CNS富集的N-乙酰转移酶8样(NAT8L)及其代谢物N -乙酰天冬氨酸(NAA)在耐药肿瘤中过表达。
在中枢神经系统中,NAA在脑部炎症时被释放。NAT8L通过NAA抑制自然杀伤细胞(NK)和CD8+ T细胞的细胞毒性,从而减轻脑炎症,损害抗肿瘤免疫。NAA通过促进PCAF诱导的lamin A- k542乙酰化,从而破坏免疫突触的形成,从而抑制lamin A与SUN2之间的整合,并损害裂解颗粒的极化。总之,该研究发现肿瘤细胞通过模仿中枢神经系统的抗炎机制来逃避抗肿瘤免疫,NAT8L是增强抗癌药物疗效的潜在靶点。

免疫检查点阻断(ICB)已经改变了癌症治疗的前景。抗肿瘤免疫反应在许多常规肿瘤疗法的治疗效果中也起着至关重要的作用,例如单克隆抗体(mAbs)。自然杀伤细胞(NK细胞)裂解抗体结合的癌细胞,这被称为抗体依赖性细胞毒性(ADCC)。此外,单克隆抗体增强树突状细胞(DC)对肿瘤抗原的摄取,从而启动抗肿瘤T细胞反应。抗HER2单抗和抗PD-1/PD-L1单抗在促进抗肿瘤免疫方面具有协同作用。
这些发现已经被一项III期KEYNOTE-8试验证实,基于该试验,抗PD-1单抗派姆单抗与抗HER2单抗曲妥珠单抗联合化疗已被批准作为局部晚期或转移性HER2+ 胃腺癌患者的一线治疗。然而,一项随机III期IMpassion050试验显示,新辅助atezolizumab(一种抗PD-Ll1单抗)联合抗HER2单抗和化疗并没有增加HER2+ 乳腺癌患者的病理完全缓解(pCR)率。因此,迫切需要阐明乳腺癌如何抑制ICB和抗HER2单克隆抗体释放的抗肿瘤免疫反应。
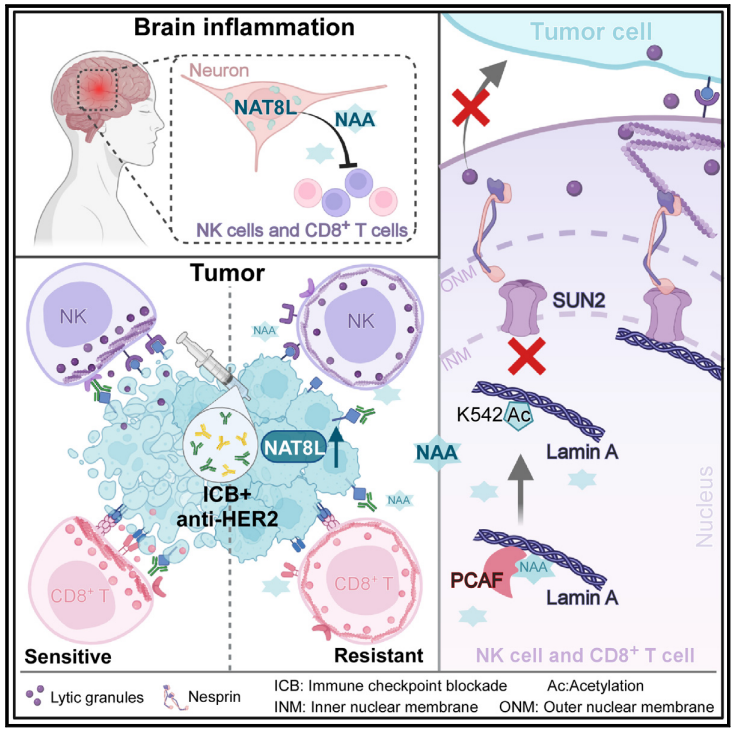
文章模式图(图源自Cancer Cell )
作为癌症的一个标志,代谢的改变会导致抗肿瘤免疫的抑制,从而导致免疫治疗的抵抗。肿瘤代谢重编程减少免疫效应细胞浸润,抑制抗原启动,阻止效应细胞扩张。抗HER2抗体和抗PD-L1抗体介导的抗肿瘤作用依赖于效应细胞的细胞毒性,需要细胞间直接接触。激活信号后,NK细胞和CD8+ T细胞形成紧密连接,并通过一个特殊的接触部位——免疫突触(immunosynapse, IS)向靶细胞释放溶解颗粒。然而,IS的形成是否可以通过肿瘤代谢转移介导,尚不清楚。
该研究进行了一项前瞻性,单臂,II期临床试验(KN035-TH-HER2),其中HER2+ 复发或转移性乳腺癌患者接受抗PD-L1单抗,曲妥珠单抗和多西他赛治疗。该研究对来自敏感患者和耐药患者的肿瘤活检进行了无偏倚的多组学分析,以研究决定乳腺癌对ICB和抗HER2单抗反应的潜在机制。
参考消息:
https://doi.org/10.1016/j.ccell.2024.05.006















