另辟蹊径!南方医科大学周伟杰团队揭示结直肠癌免疫逃逸新机制
 2026-01-08
2026-01-08
 5165
5165

iNature
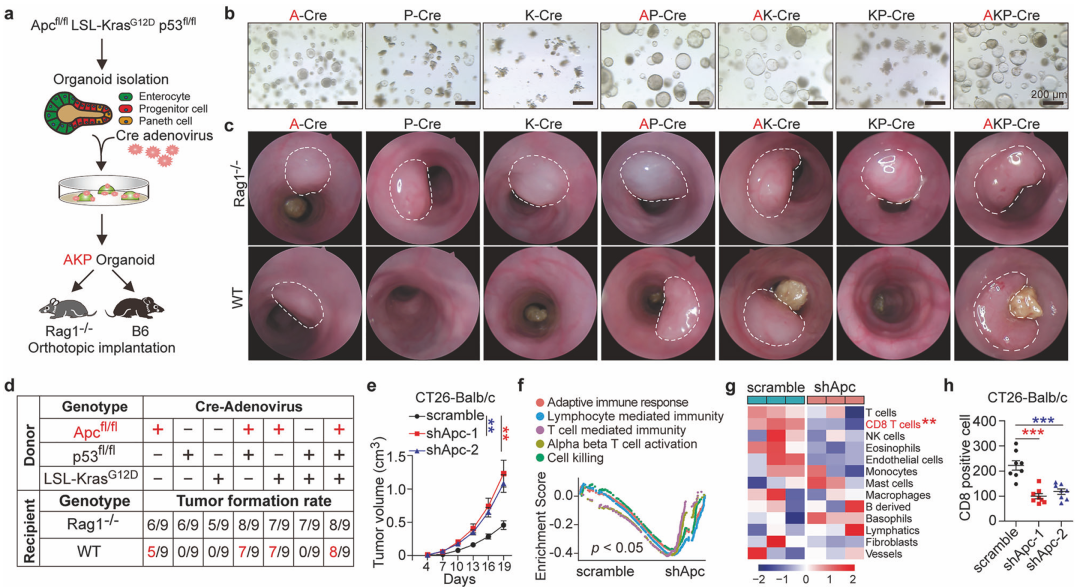
结直肠癌(CRC)在很大程度上仍然对免疫检查点阻断难治,80%-90%的病例存在腺瘤性大肠息肉病(APC)突变。以前认为APC的缺失主要通过解除对Wnt/β-catenin信号的调控来促进肿瘤进展。
2026年1月5日,南方医科大学周伟杰团队在Cell Research 在线发表题为“Targeting PTPN13 with 11-amino-acid peptides of C-terminal APC prevents immune evasion of colorectal cancer”的研究论文,该研究报道APC缺失通过蛋白酪氨酸磷酸酶非受体13 (PTPN13)对信号转导和转录激活因子1 (STAT1)的去磷酸化导致CD8+ T细胞浸润和CRC免疫逃避的抑制,而不依赖于β-catenin。
含有APC 最后11个C端氨基酸(aa)残基的肽(APC11)直接与PTPN13结合,阻断PTPN13-STAT1相互作用,促进STAT1磷酸化、干扰素调节因子-1 (IRF1)表达、主要组织相容性复合体(MHC) I类抗原呈递和T细胞瘤内浸润,最终抑制肿瘤进展,增强程序性细胞死亡1 (PD1)阻断的作用。因此,该研究确定了一种以前未知的APC/PTPN13/STAT1依赖性肿瘤免疫抑制机制。抗PD1抗体联合APC11肽的有效肿瘤抑制作用为未来开发用于结直肠癌患者的抗肿瘤药物提供了一个令人信服的靶点和理论基础。

结直肠癌(CRC)是全球第三大最常诊断的癌症,也是导致癌症相关死亡的第二大原因。尽管免疫疗法的最新进展已经彻底改变了癌症治疗,但它们对结直肠癌的有效性仍然有限。尽管以微卫星不稳定性高(MSI-H)为特征的CRC对PD1阻断反应良好,但这一子集只占所有CRC病例的不到15%。绝大多数以微卫星稳定(MSS)肿瘤为特征的CRC患者未能从这些治疗中获得显著益处,因此迫切需要新的治疗策略。CRC中免疫逃避的确切机制仍不明确。
肿瘤抑制基因腺瘤性大肠息肉病(APC)突变发生在约80%-90%的结直肠癌病例中。APC是Wnt/β-catenin信号通路的关键调节因子,APC功能的丧失是结直肠癌发生的关键驱动因素。最近的研究揭示了APC突变型CRC的复杂性,表明APC驱动的多克隆性显著增强了致瘤潜力,使肿瘤能够克服单克隆群体通常遇到的生长限制。
APC缺失导致结直肠癌免疫逃避和抗PD1治疗无效(图源自Cell Research )
在APC截短的细胞中,观察到胆固醇生物合成的异常激活。小分子TASIN-1(截断的APC选择性抑制剂-1)通过抑制胆固醇的生物合成,选择性地诱导这些细胞的细胞毒性。此外,APC截断的CRC细胞的质膜内小叶(IPM)中胆固醇水平升高通过与disheveled (Dvl)的相互作用促进Wnt信号体的Wnt独立组装。靶向胆固醇-Dvl相互作用的抑制剂可有效抑制β-catenin信号传导并降低APC截断的CRC细胞的活力。然而,APC突变在介导免疫逃避中的作用仍然知之甚少。
该研究发现蛋白酪氨酸磷酸酶非受体13型(PTPN13)是APC驱动的免疫逃避的关键介质。PTPN13,先前因其在不同肿瘤中的有争议的作用而闻名,这里揭示了STAT1的去磷酸化,从而损害IFNγ-STAT1-IRF1-MHC I类抗原递呈途径。这种去磷酸化限制了CD8+ T细胞的浸润,促进肿瘤免疫逃逸。APC直接与PTPN13相互作用,阻断其与STAT1的相互作用,从而阻止PTPN13对STAT1的去磷酸化。值得注意的是,该研究证明了APC衍生的肽,特别是C端11氨基酸(APC11),有效地阻断PTPN13-STAT1相互作用,恢复STAT1磷酸化并重新激活针对肿瘤的免疫反应。此外,当APC11肽与抗PD1抗体联合使用时,可以观察到更好的肿瘤抑制作用。
https://www.nature.com/articles/s41422-025-01206-4
















