
iNature
巨噬细胞在对小管上皮细胞(TEC)损伤时表现出高度可塑性。Gasdermin D(GSDMD)介导的焦亡可放大炎症与纤维化级联反应,但其在慢性肾脏病(CKD)中的作用仍有待阐明。
2025年12月12日,中山大学毛海萍、Li Hongyu及陈崴共同通讯在Advanced Science(IF=14.1)在线发表题为“Tubule-Derived IFN-α Promotes GSDMD-Mediated Macrophage Pyroptosis to Drive Renal Inflammation and Fibrosis Through JAK2/STAT2 Activation”的研究论文。在此,在单侧肾缺血再灌注损伤(UIRI)或叶酸诱导的肾损伤模型中,小鼠肾脏巨噬细胞内的 GSDMD 表达上调,且与焦亡率升高趋势一致。临床上,活跃片段GSDMD-N主要定位于CD68⁺巨噬细胞,其肾脏水平与纤维化严重程度呈正相关,强化其致病相关性。在两种小鼠模型中,特异性敲除巨噬细胞中的Gsdmd基因可减轻细胞焦亡、炎症反应及肾脏纤维化程度,且不会影响双侧肾缺血再灌注损伤引发的急性肾小管损伤。机制上,受损的TEC通过分泌的IFN-α启动这一级联反应,激活巨噬细胞中的IFNAR1/JAK2/STAT2轴。STAT2随后与IRF9形成复合物,直接结合GSDMD启动子,通过转录上调GSDMD表达。敲除Jak2、Stat2或Ifnar1基因可降低 GSDMD 及 GSDMD-N 的表达水平,并抑制IL-1β/IL-18的分泌。使用IFN-α中和抗体可减弱UIRI诱导的热噬细胞、炎症和肾纤维化。综上,本研究揭示了一条依赖 STAT2/IRF9 的旁分泌 IFN-α 反馈环路,该环路可调控 GSDMD 介导的焦亡过程,从而将受损肾小管上皮细胞与巨噬细胞驱动的肾脏炎症及纤维化进程关联起来。靶向该信号轴有望成为延缓慢性肾脏病进展的潜在治疗策略。

慢性肾病(CKD)是一个日益严重的全球公共卫生问题,无论病因如何,最终都会发展为肾纤维化。目前的治疗方法在打断炎症-纤维化循环方面效果有限,使肾纤维化不可逆转,并凸显了机制上的空白。巨噬细胞是肾炎症和纤维发生中的核心调节因子。巨噬细胞最初通过限制受损TECs和促进修复来应对肾小管损伤,从而协调组织修复。然而,TEC不完全消退或持续损伤会触发巨噬细胞激活,分泌炎症性和促纤维化介质,促进纤维化。新兴证据表明,焦亡是该过程的关键调节因子。巨噬细胞焦亡虽能抵御感染,但其调控失衡会加剧肾脏炎症与纤维化。在尿路梗阻模型中,受损肾小管上皮细胞可通过释放ATP诱导巨噬细胞焦亡,进而放大纤维化应答。但目前,连接肾小管上皮细胞损伤与巨噬细胞焦亡的具体信号通路仍未明确。GSDMD是介导焦亡的核心效应分子,可调控细胞膜孔道形成与细胞因子释放。经典的核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体激活过程分为两步:首先是启动信号刺激,随后是效应信号,进而激活caspase-1,介导GSDMD 剪切活化,最终促使IL-1β、IL-18释放。尽管已有研究证实,GSDMD 介导的巨噬细胞焦亡会加剧疾病的炎症与纤维化进程,但其在慢性肾脏病中的作用仍未阐明。既往研究表明,骨髓或中性粒细胞来源的GSDMD 参与肾纤维化的调控,且在尿路梗阻模型中肾小管上皮细胞来源的 ATP 可驱动巨噬细胞焦亡。因此,巨噬细胞GSDMD 介导的焦亡在肾纤维化中的具体作用亟待明确。信号转导器和转录激活因子(STAT)家族成员调控炎症反应期间gasdermin基因的转录。在急性肾损伤(AKI)进程中,STAT1可介导肾小管上皮细胞焦亡;而在动脉粥样硬化病变的巨噬细胞中,STAT3可上调气膜蛋白E的表达。III型干扰素(IFNs)是Janus激酶(JAK)/STAT途径的关键激动剂,促Z-DNA结合蛋白1/caspase-8/gasdermin C(GSDMC)介导的肠道上皮细胞内的焦亡,损害黏膜修复并引发炎症性肠病。然而,STAT家族成员与肾巨噬细胞纤维化期间GSDMD转录之间的机制相互作用尚未被表征,可能是情境依赖性的焦凋亡机制的潜在原因。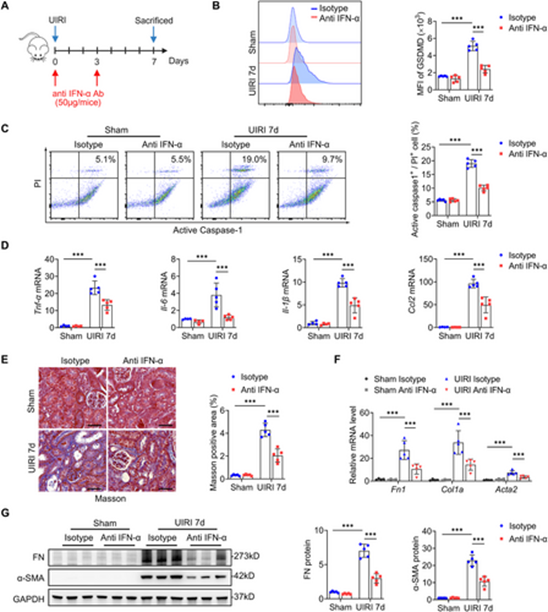
IFN-α中和能减轻UIRI诱导的肾巨噬细胞焦亡、炎症反应及肾脏纤维化(摘自Advanced Science )
本研究借助单侧肾缺血再灌注损伤(UIRI)和叶酸(FA)肾病两种小鼠模型证实,巨噬细胞是肾脏中GSDMD的主要表达细胞,且焦亡水平升高与纤维化严重程度呈正相关。特异性敲除巨噬细胞中的Gsdmd基因、过继输注GSDMD缺陷型巨噬细胞或中和干扰素α(IFN-α),均可减轻肾脏炎症与纤维化程度。机制研究表明,受损肾小管上皮细胞分泌的IFN-α可激活巨噬细胞内的干扰素α/β受体1(IFNAR1)/JAK2/STAT2信号轴;STAT2会与干扰素调节因子9(IRF9)形成复合物,直接结合至Gsdmd基因的启动子区域,进而上调其转录水平。上述研究结果揭示了一条介导焦亡的“肾小管上皮细胞-巨噬细胞”IFN-α/STAT2/IRF9反馈环路,并证实该信号轴有望成为慢性肾脏病治疗的潜在靶点。https://doi.org/10.1002/advs.202512278

 2025-12-19
2025-12-19
 4292
4292



















