颜宁/黄健团队再取研究进展!
 2025-07-08
2025-07-08
 6484
6484

iMedicines
2025年7月4日,深圳医学科学院黄健、颜宁共同通讯在Cell Research(IF=25.9)在线发表题为“Phrixotoxin-3 binds to three distinct antagonistic sites on human Nav1.6”的研究论文,该研究发现Phrixotoxin-3与人类Nav1.6上的三个不同拮抗位点结合,蜘蛛毒素Phrixotoxin-3(PaurTx3)通过三位点协同调控人源电压门控钠通道Nav1.6。

Nav1.6在调节放电动作电位所需的电压阈值方面至关重要,并且能够产生复活电流,即在中间复极电位下去极化后引发的小电流和瞬态电流。这些特性将Nav1.6定位为神经元兴奋性的关键调节器,从而将其与癫痫等神经系统疾病紧密联系起来。尽管它作为开发亚型选择性抗癫痫药物的潜在靶点具有重要意义,但与其他人类Nav亚型相比,对各种试剂对Nav1.6调节的结构见解仍然有限。
Phrixotoxin-3(PaurTx3)是一种34个残基的肽毒素,来源于金斑狼蛛。它与其他几种蜘蛛毒素(包括ProTx II和HWTX-IV)共享类似的抑制剂胱氨酸结(ICK)支架。PaurTx3在某些亚型上具有功能特征,如Nav1.2和Nav1.7,并通过诱导门控动力学中的去极化转变作为强效Nav阻断剂发挥作用,这是典型GMT的特征。据报道,毒素活性受到蛋白质脂质化的影响,但其机制仍有待阐明。
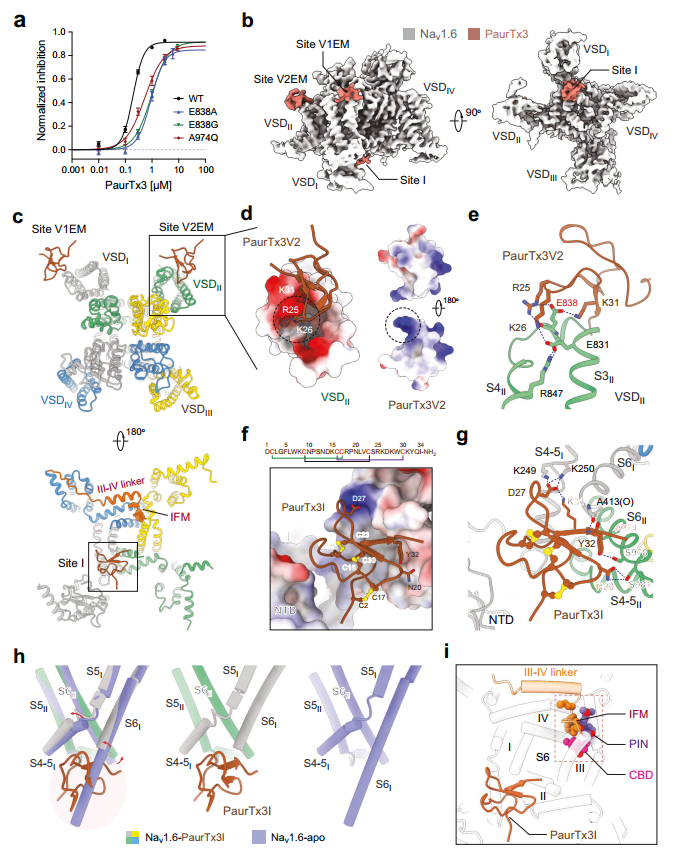
PaurTx3与Nav1.6上的三个不同位点结合(图源自Cell Research)
在该研究中,研究团队首次完整解析了 PaurTx3毒素与 Nav1.6 结合的复合物结构。令人惊讶的是,PaurTx3 并非单点调控,而是与三个不同拮抗位点结合,从而精准靶向 Nav1.6 通道——电压感受结构域 VSDI、VSDII ,以及通道胞内门控位点(位点I)。这项研究不仅揭示了毒素多点协同调控 Nav1.6 的机制,还为结构导向的多肽类药物设计带来诸多启发,有望开发靶向 Nav1.6 通道且具有全新作用模式的抗癫痫、镇痛及神经保护药物。
北京生物结构前沿研究中心研究员、深圳医学科学院创始院长、深圳湾实验室主任颜宁和深圳医学科学院特聘研究员黄健为论文共同通讯作者。原普林斯顿大学分子生物学系博士后范潇和清华大学生命科学学院博士后陈娇凤为论文共同第一作者。
















