Immunity:中山大学邝栋明、陈东萍团队揭示肝癌中多胺代谢重编程驱动免疫抑制的新机制
 2025-06-10
2025-06-10
 6375
6375

代谢重编程(metabolic reprogramming)是肿瘤进展的标志性特征之一,其中最为经典的是肿瘤细胞通过增强有氧糖酵解以满足快速生长与增殖的代谢需求。除高增殖潜能外,侵袭转移、血管新生、免疫逃逸和治疗耐受等亦是肿瘤恶性演化的重要表型。深入理解代谢重编程与这些恶性表型之间的内在联系,对于开发更具靶向性和持久疗效的抗肿瘤策略具有重要意义。
值得注意的是,肿瘤的代谢特征及其伴随的生物学行为在疾病进程中呈动态演化,然而,当前关于代谢重编程如何驱动免疫逃逸和治疗抵抗中的系统机制与直接证据仍较为匮乏。
2025 年 6 月 2 日,中山大学邝栋明教授、陈东萍副教授团队在 Immunity 杂志在线发表题为 Efflux of N1-acetylspermidine from hepatoma fosters macrophage-mediated immune suppression to dampen immunotherapeutic efficacy 的研究论文。该研究基于多队列肝癌样本,整合代谢组学、转录组学测序和单细胞测序等多组学数据,并结合体内外功能实验,系统阐明了肿瘤细胞通过代谢重编程产生并主动外排 N1-乙酰亚精胺(N1-acetylspermidine,N1-Ac-Spd),诱导免疫抑制性巨噬细胞和调节性 T 细胞,进而削弱肿瘤免疫治疗效能的分子机制。该工作为靶向多胺代谢轴以增强肿瘤免疫治疗提供了理论基础和潜在的干预靶点。

多胺(polyamines)是一类高电荷密度的低分子量脂肪族多阳离子,天然多胺包括腐胺(putrescine)、亚精胺(spermidine)和精胺(spermine),在维持细胞增殖、转录调控及核酸稳定性中发挥关键作用。在多种肿瘤中,受 MYC 扩增或 KRAS 突变等驱动因素影响,多胺代谢持续激活,从而支持癌细胞的持续生长。传统观念认为多胺的功能局限于细胞内,但最新研究发现,多胺可经 N1-乙酰化修饰后,通过转运蛋白 SLC3A2 外排至胞外环境。尽管多胺代谢长期未被归入免疫调控通路,近期研究发现其可抑制髓系细胞,尤其是巨噬细胞的免疫功能,显示其在肿瘤免疫微环境中的潜在致病作用。然而,多胺外排在肿瘤免疫调控中的具体功能与机制仍缺乏直接实验证据。
该研究通过转录组测序与串联质谱联合分析,发现肝癌组织中多胺代谢通路高度活跃,但并非以天然多胺的积累为特征,而是显著增强了 N1-Ac-Spd 的合成及外排。重要的是,N1-Ac-Spd 并不直接作用于癌细胞,而是作为「代谢介质」调控免疫细胞功能,从而间接促进肿瘤免疫逃逸和疾病进展。同时,血浆中 N1-乙酰化亚精胺被鉴定为肝癌免疫治疗耐药的潜在生物标志物。
机制研究显示,肝癌微环境中的炎性巨噬细胞通过 TNF-α 依赖的方式刺激肿瘤细胞上调精胺/亚精胺 N1-乙酰转移酶(SAT1),进而催化亚精胺发生 N1-乙酰化修饰,并通过 SLC3A2 转运体介导其主动外排。外排的 N1-Ac-Spd 反作用于巨噬细胞,以电荷依赖的方式激活 SRC 信号通路,驱动其向 CCL1+ 巨噬细胞极化,从而募集 CCR8+ 调节性 T 细胞,形成免疫抑制网络。在动物模型中,阻断 N1-Ac-Spd 的合成或其介导的免疫抑制通路,显著增强了免疫检查点治疗的疗效,并促进肿瘤消退。
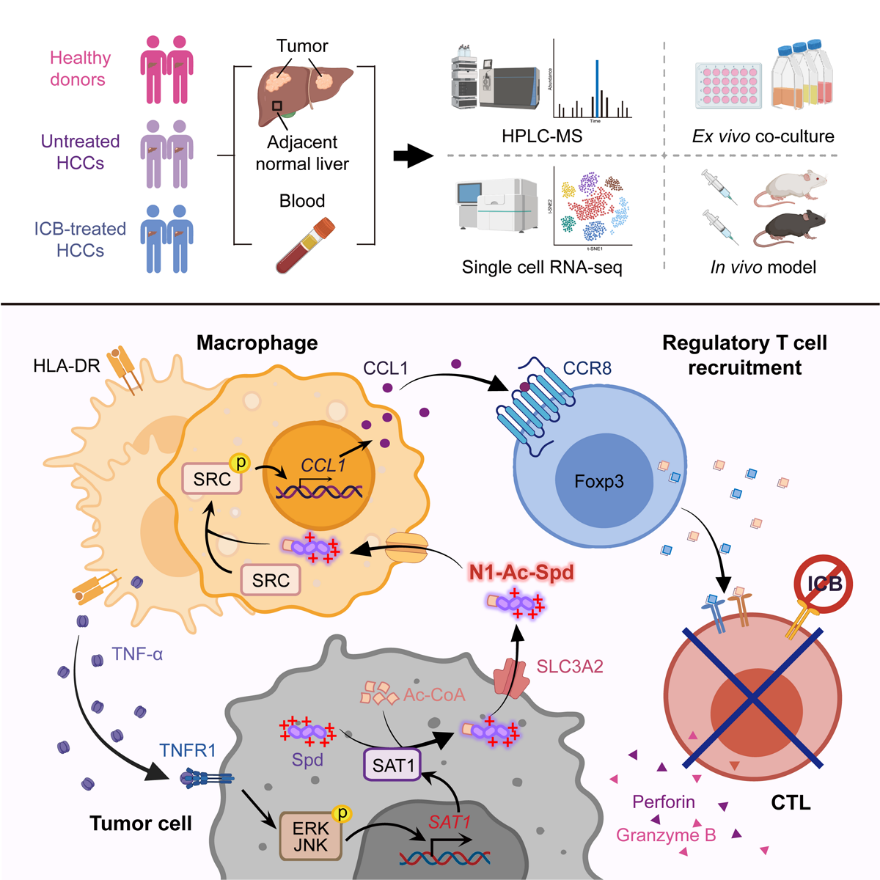
综上所述,该研究研究以肝癌为模型,揭示了肿瘤代谢产物 N1-Ac-Spd 在构建免疫抑制微环境中的关键作用,率先提供了多胺代谢重编程导致免疫治疗耐受的直接证据,阐明其通过免疫细胞功能削弱抗肿瘤免疫反应。该发现为靶向多胺代谢改善免疫治疗效果提供了新的理论依据和潜在临床策略。
该研究由中山大学生命科学学院刘政宇博士、中山大学生命科学学院吴财源博士和吴锐奇博士共同担任论文的第一作者。中山大学肿瘤防治中心劳向明教授和南京医科大学陈云教授为研究提供了重要的临床资源支持。中山大学生命科学学院郑利民教授、中山大学肿瘤防治中心张耀军教授及王骏成医生亦为本研究给予了重要支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S1074761325002274
















