登上Nature头条!她自制病毒,成功治疗自己的癌症!
 2024-11-19
2024-11-19
 7654
7654

一位科学家通过注射实验室培育的病毒,成功治疗了自己的乳腺癌。日前,《自然》官网头条发文,讲述了病毒学家贝娅塔·哈拉西(Beata Halassy)的“自救”故事。
53岁的哈拉西在克罗地亚萨格勒布大学从事病毒研究工作。2016年,她被诊断出“三阴性浸润性乳腺导管癌”——一种恶性程度高、极易复发转移的类型,素有“最毒乳腺癌”之称。
即便手术尽可能切除病灶,哈拉西的癌症还是两次复发。第二次复发、转移时,她拒绝化疗,而是在实验室“自制”病毒,为自己实施了一种新兴的肿瘤免疫治疗方法:“溶瘤病毒(OV)疗法”。
“自我治疗”不久后,哈拉西的肿瘤体积显著缩小,性质发生变化,侵袭性边缘消退,为外科完全切除创造了有利条件。如今,4年过去了,她的病情依然稳定,乳腺癌未再复发。
然而,当她把这项研究成果拿去发表时,却被十几家期刊拒稿,理由是涉及自体试验,存在伦理风险。而哈拉西却觉得,自己只是想探讨一种潜在的癌症治疗方法。

贝娅塔·哈拉西(Beata Halassy)/图源:Narod.hr
自制病毒治癌症,这一疗法什么来头?
2016年,哈拉西诊断出患有三阴性乳腺癌。截至2020年,她已两次复发,尤其是第二次,病情进展到了临床III期,早前手术后残留的血清肿结构变成直径2厘米的实体瘤,癌细胞扩散、侵入皮肤和胸肌。
“癌症转移了,情况比此前糟得多。”哈拉西表示,自己不想再做一轮手术和放化疗。不仅身体扛不住,效果也可能不会太好。
所谓“三阴性”,就是3个乳腺癌特异性受体表达均为阴性。这意味着患者缺少靶向治疗、内分泌治疗等机会,可选择的治疗手段仅限手术、放化疗。一旦复发,常规化疗的效用会再打折扣。
哈拉西长期从事病毒性疾病的免疫治疗等研究。阅读大量文献后,她想在自己身上验证一种乳腺癌实验性治疗思路:溶瘤病毒疗法。
溶瘤病毒并非特定的一种病毒,而是一类病毒,能够感染癌细胞,在其内特异性复制并引起癌细胞凋亡,同时保留正常组织不被破坏。中山大学附属第三医院神经外科将其比作“肿瘤战场中的隐秘勇士”,“就像一个通过特定编程的特工,只攻击和摧毁癌细胞,而对正常细胞无害”。
实际上,学界对溶瘤病毒的研究已有上百年。近些年,溶瘤病毒疗法利用基因工程手段对溶瘤病毒进行改造,使其失去毒性并保留了病毒的复制能力,可杀伤肿瘤细胞,达到治疗目的。
梅奥诊所血液学教授斯蒂芬·罗素(Stephen Russell)从事溶瘤病毒研究多年,他解释,溶瘤病毒治疗分为两个阶段,其一是“直接攻击”,即病毒直接感染癌细胞、致其死亡。
“正常细胞被病毒感染后,会出现程序性死亡等自然免疫反应,以防病毒复制、扩散。但癌细胞没有这种免疫能力。因此,一个癌细胞被病毒感染,可能繁殖出千上万个病毒,进而攻击邻近癌细胞。”罗素说。
第二阶段是免疫系统“大作战”。
一般情况下,癌细胞善于“伪装”,会通过减少抗原呈递,避免被免疫系统识别。它们还可能“招募”肿瘤相关成纤维细胞(CAF)等,形成“保护网”,拦截免疫细胞进入癌细胞集群。
而经基因编辑后的溶瘤病毒能穿透癌细胞并繁殖,会大量释放病毒颗粒和细胞内容物,触发免疫系统的防御、识别机制。通俗来讲,添加治疗性基因修饰后的溶瘤病毒,可以更好地激活免疫系统,增强抗肿瘤效果。
掌握原理后,哈拉西向肿瘤医师交流了自己的想法。她提议,先对自己局部注射病毒,再视情况进行其他治疗,如果病毒治疗无效,再进行常规化疗。
“哈拉西,你就不能循规蹈矩地治病吗?”肿瘤医师告诉她。
“不行。”哈拉西说。
病毒起效后,乳腺癌发生显著变化 前期铺垫工作完成后,哈拉西开始了她的“自我治疗”。
利用自己掌握的病毒学知识,哈拉西能够熟练操作培养、纯化等技术。在同事帮助下,她最终选定麻疹病毒(MeV)、水疱性口炎病毒(VSV)进行试验。
该选择基于多方面考虑:病毒必须能感染上皮细胞,这是乳腺癌来源的细胞类型;经过测试,上述病毒曾被证明有抗乳腺癌潜力;必须是自然界病毒、无需基因工程改造,避免外泄风险;必须低毒、不会造成严重疾病。
更重要的是,这些病毒早已在哈拉西实验室中存在,她有丰富的处理经验。
随后2个月里,哈拉西将自己亲手培养的实验室级别病毒,分10次注入自身乳腺病灶中。先是每3-4天注射1次MeV,共计7次,而后再按照每2周、1周的时间间隔,注射3次VSV。
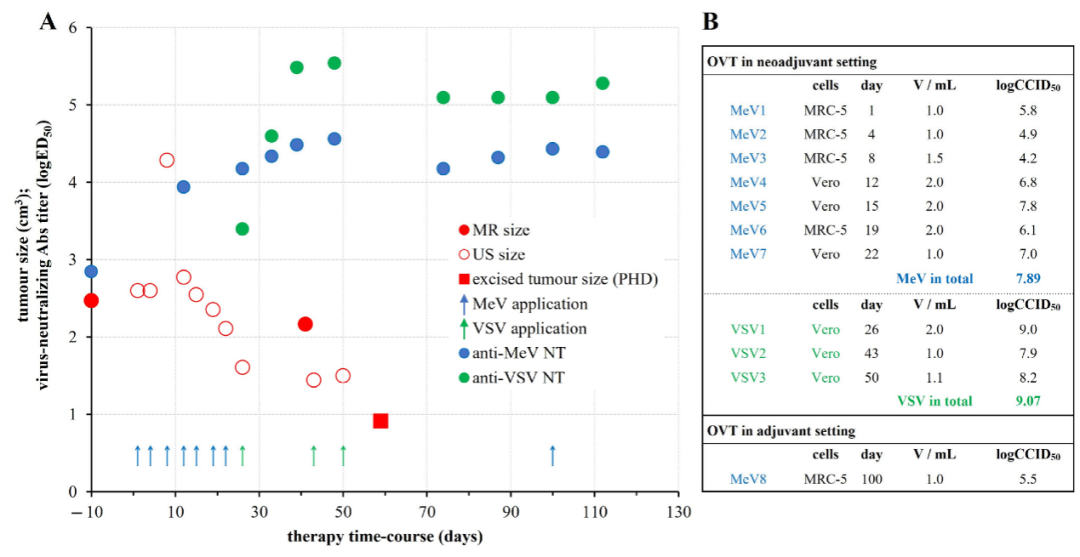
溶瘤病毒疗法的方案和结果。图源/Vaccines
从第一次注射算起,两个月后,疗效明显。
检测报告显示,哈拉西的肿瘤体积缩小约63%,从2.47cm3显著缩减至0.91cm3;性质发生变化,从一个硬的、伴有皮肤炎症的固定结节,变成软的、没有皮肤炎症的可移动结节;肿瘤的侵袭性边缘也出现了消退迹象。
紧接着,哈拉西做了根治切除术。术后组织病理学分析显示,肿瘤局限于皮下,没有皮肤或胸肌浸润。此外,肿瘤中出现淋巴细胞彻底浸润,各类免疫细胞数量显著提升。
这都说明,溶瘤病毒成功激活了哈拉西体内的免疫系统,并引导其攻击癌细胞。更神奇的是,溶瘤病毒治疗后,哈拉西的肿瘤从PD-L1阴性,转变为PD-L1阳性。
基于此,她可以采用以HER-2为靶点的靶向药物进行治疗,可选择的治疗方式多了起来。为巩固溶瘤病毒疗效,在术后两个月左右,哈拉西于手术缝合处皮下又注射了1次MeV。
回顾整个治疗过程,哈拉西表示“很顺利”。她介绍,注射病毒初期,可能是因为局部炎症、免疫细胞聚集,肿瘤曾一度增大,此后才逐渐缩小。其他全身性不良反应包括发烧、僵硬等,也都随着时间不断缓解。
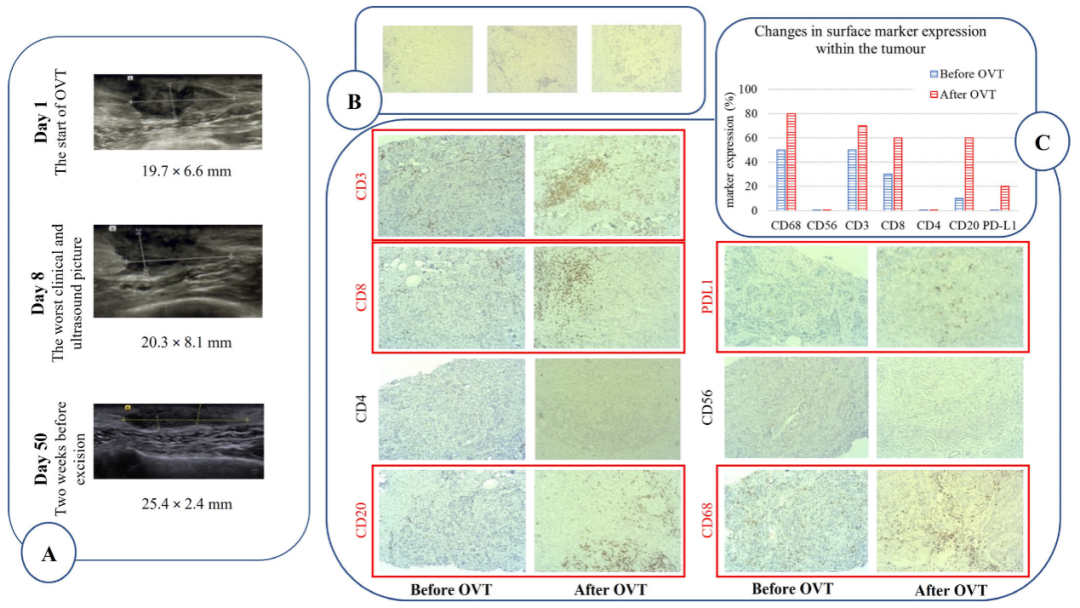
溶瘤病毒疗法效果的影像学证据。图源/Vaccines
事实上,在哈拉西之前,学术界鲜有溶瘤病毒治疗乳腺癌的相关研究。最早在2023年2月,《自然-医学》发文,首次探讨了粒细胞和巨噬细胞集落刺激因子编码基因工程溶瘤单纯疱疹病毒T-VEC联合蒽环类+紫杉类标准新辅助化疗,对早期三阴性乳腺癌术前患者的有效性和安全性。
共有37例患者完成这项研究,结果显示:治疗期间,免疫激活水平与疗效呈正比;残癌负荷指数为0占45.9%,残癌负荷指数为0-1占65%;2年无复发生存率为89%,残余癌负荷指数为0-1的患者均未复发。
此外,在治疗过程中,常见的T-VEC毒性为发热、寒战、头痛、疲劳、注射部位疼痛。新辅助化疗毒性符合预计。发生血栓栓塞事件4例。
T细胞杀灭肿瘤细胞的过程。图源/unchartedterritories
专家提醒:其他人不应该尝试 成功治疗自己的乳腺癌后,哈拉西希望记录成文,供全球学界讨论,但投稿过程很不顺利。
在文章被最终接收、刊发前的近三年时间里,她累计投稿13次,均被期刊拒收。哈拉西坦言,这一结果在意料之中,她分析,拒稿原因可能包括论文撰写专业性较弱、团队对肿瘤专业了解甚少等。
值得注意的是,这项研究存在诸多“缺陷”,尤其是作为一项自体研究,它无法保证临床试验符合科学和伦理道德要求,未经伦理委员会批准,同时所用病毒也属于实验室级别而非临床级。
“更重要的问题在于,期刊发表这一(研究)结果,可能会鼓励其他人拒绝传统治疗,而尝试类似的未经验证的方案。”美国伊利诺伊大学厄巴纳-香槟分校法学教授雅各布·谢尔科夫(Jacob Sherkow)指出。他曾参与多项新冠疫苗自体试验的伦理学研究。
即便屡次被期刊拒之门外,罗素仍认可哈拉西的努力。但他提醒,使用两种及以上病毒分次注入肿瘤内,可能不是“创新性”方案,在n=1的研究中也无法得出明确结论。“事实上,她(治疗方案)的新颖之处可能更多在于使用实验室级别病毒自疗。”

贝娅塔·哈拉西(Beata Halassy)/图源:Narod.hr
哈拉西表示,业界的关注点可能跑偏了,“我想探讨一种有望成为癌症一线疗法的治疗思路,以及接下来该如何验证它。大家却在讨论为何这篇文章不该发。”截至本文发布,哈拉西的乳腺癌无复发期已达4年。
最终,这篇文章以《复发性乳腺癌新辅助溶瘤病毒治疗的非常规病例研究》为名,发表在了今年8月的《疫苗》上。该期刊专注于实验室和临床疫苗研究、利用和免疫。
文章在“讨论”“结论”部分多次强调研究的“非常规性”:“这是一项孤立且非常规的研究。作者明确指出,溶瘤病毒自我治疗不应成为癌症诊断后的首选方案。但希望鼓励业界开展正式的临床试验,以评估溶瘤病毒作为新辅助疗法的效用。”
哈拉西指出,溶瘤病毒疗法的抗肿瘤机制不同于其他疗法,毒性作用有限,因此可以与大多数其他疗法联用,包括全身化疗、免疫治疗、靶向治疗等。
对此,医疗界已有所尝试。包括美国和日本在内,全球已批准4款溶瘤病毒产品上市,用于治疗恶性黑色素瘤、胶质瘤等肿瘤。还有一些药品获得孤儿药资格认定,或被纳入突破性治疗品种。它们均采用经基因工程改造的病毒。
其中一款是中国企业自主研发,产品已在国内获批上市,用于晚期鼻咽癌的瘤内注射。根据《基因重组溶瘤腺病毒治疗恶性肿瘤临床应用中国专家共识(2022年版)》,中国至少有6款在研产品,主要适应证包括晚期实体瘤、肝部或头颈部肿瘤等。
此外,中国科学院院士刘新垣综合溶瘤病毒和基因治疗优缺点,提出“癌症的靶向基因-病毒治疗”策略。一款“中美双报”抗癌药物目前正在多家三甲医院进行I期临床试验,在快速推进的溶瘤病毒赛道中引发关注。