提起β桶上的盖子
 2020-04-02
2020-04-02
 6013
6013
生物素和链霉亲和素之间的相互作用是生物纳米技术中公认的实验工具。LMU的物理学家现在表明,复合物的机械稳定性取决于界面的精确几何形状。
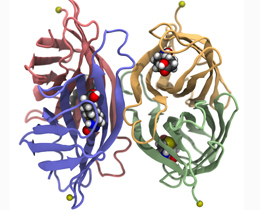
链霉亲和素由四个相同的亚基组成(此处以绿色,蓝色,黄色和红色显示),每个亚基都可以结合生物素分子(彩色球体)。在实验中,链霉亲和素固定在锚点(黄色球体)上,而生物素分子则从其中一个结合袋中拉出。资料来源:拉斐尔·伯纳迪(Rafael C. Bernardi)。
机械力在生物系统的各个层面上都起着至关重要的作用。肌肉细胞的收缩和松弛无疑是最著名的例子,但是实际上在所有细胞中都发现了机械敏感性蛋白。例如,由机械受体感测到由血流施加在位于血管上的细胞上的剪切应力,该机械感受器触发了控制血管直径的信号传导途径。在努力理解介导此类过程的分子机制的过程中,科学家们通过分析机械敏感蛋白在机械应力下的行为来研究其敏感性。这些实验中的许多实验都依赖于生物素(一种维生素)与其结合蛋白链霉亲和素之间紧密而高度特异性的相互作用的使用作为测力计。Hermann Gaub现在已经对该复合物的机械稳定性进行了详细的分析,该分析发表在《科学进展》杂志上。他们的发现表明,受体中配体与其结合口袋之间的界面几何形状对复合物的稳定性有显着影响,在评估实验数据时必须考虑这一因素。
分子销钉
物理学家使用一种称为单分子力谱的技术来测量生物分子对机械力的反应。在这种方法中,目标蛋白被放在两个分子标签之间。其中之一用于将蛋白质共价结合到载玻片上。另一个链接到一个设置,该设置使实验者可以在蛋白质上施加渐变的力。通常,该第二接头利用生物素和链霉亲和素之间的非共价相互作用。高博团队成员,论文的主要作者斯特芬·塞德拉克(Steffen Sedlak)说:“这种配体-受体系统是力谱的'原始插头' 。”
生物素标签共价附于蛋白质本身,因此可用于与链霉亲和素的高亲和力结合。在这些实验中,配体与其受体之间相互作用的显着机械稳定性是至关重要的因素。自大约25年前Gaub在该系统上进行首次力谱试验以来,全世界范围内的实验室都通过力谱测量了配合物对机械力的响应。但是,在不同设置下获得的结果不一致,并且显示出很大的变化范围。这项新研究着手确定其原因。
链霉亲和素蛋白由四个结构相似的结构域组成,称为“β-桶”,因为它们由排列成类似于酒桶壁的平行链组成。这些桶中的每个桶都可以容纳一个生物素分子-像每个自重桶一样,每个桶都配有一个盖,该盖在结合的生物素上封闭。在这种构象中,生物素只能从另一端(与目标蛋白质相连的一端)进入。
从桶中提取生物素
对于他们的实验,Sedlak和他的同事们创建了链霉亲和素蛋白的几种突变体。在每种情况下,只有一个特定的桶状结构能够结合生物素,而其他三个则保持空白。为了测量与每个独立桶结合的稳定性,研究小组测量了将结合的生物素从四种链霉亲和素蛋白中拉出所需的力。“我们发现提取生物素所需的力的大小取决于它所在的四个桶中的哪一个,即使所有四个活性结合口袋都完全相同,” Gaub解释道。
出门还是穿墙?
在复杂的计算机模拟的帮助下,团队能够弄清楚这些令人惊讶的发现的原因。当受到逐渐增大的机械力时,在力变得足够大以使其移位之前,不同口袋中的生物素分子显然占据了不同的位置。这进而改变了随后施加力的几何形状,并且该因素可以解释每个凹穴的响应的差异。当力能够作用在β枪管的柔性盖上时,提取最容易发生,但是如果在其他任何位置施加张力,则系统可以抵抗更大的压力。“正如Diogenes本人肯定地发现的那样,抬起盖子比松开五线谱更容易从枪管中退出,” Sedlak说。
作者认为,这些结果将使优化链霉亲和素用于力谱实验中成为可能-通过允许实验者调整销钉在枪管中的位置的稳定性。















