脊椎动物的骨骼发育可分为膜内成骨和软骨内成骨两种形式,其中软骨内成骨是体内大部分骨骼发育与形成的主要方式。软骨内成骨发生时,间充质细胞首先在骨组织发育部位聚集并分化为软骨原细胞并形成软骨原基,软骨原基发育形成生长板,介导骨骼的生长。经过一系列的分化、增殖、成熟和凋亡等过程后,软骨细胞发生分化并分泌不同的细胞外基质,逐步被骨组织所替代。这一过程在幼年期持续进行,成年后生长板软骨细胞耗竭,骨骼停止生长,而关节软骨细胞则保持未分化状态, 维持关节的灵活运转【1】。超负荷压力与劳累易导致骨骼损伤,此时机体会激活骨膜内的骨骼祖细胞并启动发育性软骨内成骨过程,最终完成受损骨骼的修复【2】。近年来研究发现,软骨内成骨过程受到包括BMP、TGF-β、Wnts和Notch等在内的诸多信号通路的精细调控,其中转录因子Sox9能够调节软骨发生和生长板软骨细胞分化等过程,是软骨内成骨的关键调控因子【3】。然而,骨骼祖细胞中的Sox9是如何被激活的,目前仍不清楚。此外,组织细胞的稳态维持有赖于以血管为载体的循环系统不断供应营养物质,而软骨作为一种特殊的无血管组织,营养供应的缺乏是否以及如何调节软骨形成的也亟待研究。近日,比利时鲁汶大学Geert Carmeliet教授团队在Nature杂志发表长文Lipid availability determines fate of skeletal progenitor cells via SOX9,揭示了骨愈合过程中,细胞外脂类水平决定了软骨内成骨过程,而低脂条件下的转录因子FOXO通过调节Sox9的表达影响了骨骼祖细胞的命运决定。 研究伊始,作者探究了软骨的无血管特性是否影响了骨骼祖细胞的命运决定。通过将有活性的自体骨组织移植入股骨受损的小鼠体内以诱导骨膜驱动的愈合反应,作者发现靠近宿主-移植骨边界的骨膜细胞会形成软骨,而中心细胞则直接分化为成骨造骨细胞。此外,骨膜细胞不会促进骨愈合组织的血管形成,但由于骨膜细胞能够将血管吸引至骨愈合处,因此会极大程度地促进血管向内生长。在血液供应受限情况下,骨骼祖细胞发生软骨化而非成骨性分化,以确保骨愈合的完成。骨骼愈合过程中血管会不断带来营养成分和生长因子等物质,利用骨愈合计算模型,作者证明血管提供的营养物质能潜在地调控骨骼祖细胞的分化。随后,作者利用骨骼祖细胞体外模型研究了营养因素对骨骼祖细胞细胞命运的影响。营养胁迫、低氧或血清剥夺会导致祖细胞或骨膜细胞中SOX9显著上调,而在上述细胞中敲低Sox9会使细胞受到营养胁迫(或血清剥夺)后存活率下降,这表明骨骼祖细胞能通过上调Sox9水平快速适应营养胁迫。血清是细胞生长所需脂类的主要来源,利用骨骼祖细胞体外模型和胚胎跖骨培养的类器官模型,作者发现低脂血清处理会显著上调祖细胞中的SOX9,且会促进骨膜细胞的软骨分化,而外源脂类处理会在一定程度上挽救上述表型。因此,血管形成受阻引发的低脂质水平很可能是骨愈合过程中骨膜软骨形成的决定因素。而局部低脂肪含量对软骨形成有利是由于软骨细胞表现出与局部脂质缺乏相一致的的低脂肪酸氧化(FAO, fatty acid oxidation)率,其代谢并不依赖于外源性脂质。作者进一步研究发现,细胞外脂类含量降低时,骨骼祖细胞通过动员溶酶体介导的细胞内脂质储存来暂时维持FAO和正常生存。由于脂质剥夺后SOX9上调和总FAO水平降低同时发生,因此两者间很可能存在相关性。作者发现骨膜细胞中SOX9敲除会上调FAO水平,而在颅骨成骨细胞中过表达SOX9会使FAO水平降低,因此SOX9通过抑制FAO在软骨细胞中发挥代谢调节作用。最后,作者研究了骨骼祖细胞中的脂类是如何影响SOX9水平的。血清剥夺后的转录组测序及后续的转录因子结合分析表明,转录因子FOXOs能在脂类匮乏时调节Sox9的表达水平。在骨愈合过程中,FOXO信号受脂类水平的负调控,FOXO1和FOXO3a等FOXO分子对骨骼祖细胞介导的软骨形成和存活必不可少。
研究伊始,作者探究了软骨的无血管特性是否影响了骨骼祖细胞的命运决定。通过将有活性的自体骨组织移植入股骨受损的小鼠体内以诱导骨膜驱动的愈合反应,作者发现靠近宿主-移植骨边界的骨膜细胞会形成软骨,而中心细胞则直接分化为成骨造骨细胞。此外,骨膜细胞不会促进骨愈合组织的血管形成,但由于骨膜细胞能够将血管吸引至骨愈合处,因此会极大程度地促进血管向内生长。在血液供应受限情况下,骨骼祖细胞发生软骨化而非成骨性分化,以确保骨愈合的完成。骨骼愈合过程中血管会不断带来营养成分和生长因子等物质,利用骨愈合计算模型,作者证明血管提供的营养物质能潜在地调控骨骼祖细胞的分化。随后,作者利用骨骼祖细胞体外模型研究了营养因素对骨骼祖细胞细胞命运的影响。营养胁迫、低氧或血清剥夺会导致祖细胞或骨膜细胞中SOX9显著上调,而在上述细胞中敲低Sox9会使细胞受到营养胁迫(或血清剥夺)后存活率下降,这表明骨骼祖细胞能通过上调Sox9水平快速适应营养胁迫。血清是细胞生长所需脂类的主要来源,利用骨骼祖细胞体外模型和胚胎跖骨培养的类器官模型,作者发现低脂血清处理会显著上调祖细胞中的SOX9,且会促进骨膜细胞的软骨分化,而外源脂类处理会在一定程度上挽救上述表型。因此,血管形成受阻引发的低脂质水平很可能是骨愈合过程中骨膜软骨形成的决定因素。而局部低脂肪含量对软骨形成有利是由于软骨细胞表现出与局部脂质缺乏相一致的的低脂肪酸氧化(FAO, fatty acid oxidation)率,其代谢并不依赖于外源性脂质。作者进一步研究发现,细胞外脂类含量降低时,骨骼祖细胞通过动员溶酶体介导的细胞内脂质储存来暂时维持FAO和正常生存。由于脂质剥夺后SOX9上调和总FAO水平降低同时发生,因此两者间很可能存在相关性。作者发现骨膜细胞中SOX9敲除会上调FAO水平,而在颅骨成骨细胞中过表达SOX9会使FAO水平降低,因此SOX9通过抑制FAO在软骨细胞中发挥代谢调节作用。最后,作者研究了骨骼祖细胞中的脂类是如何影响SOX9水平的。血清剥夺后的转录组测序及后续的转录因子结合分析表明,转录因子FOXOs能在脂类匮乏时调节Sox9的表达水平。在骨愈合过程中,FOXO信号受脂类水平的负调控,FOXO1和FOXO3a等FOXO分子对骨骼祖细胞介导的软骨形成和存活必不可少。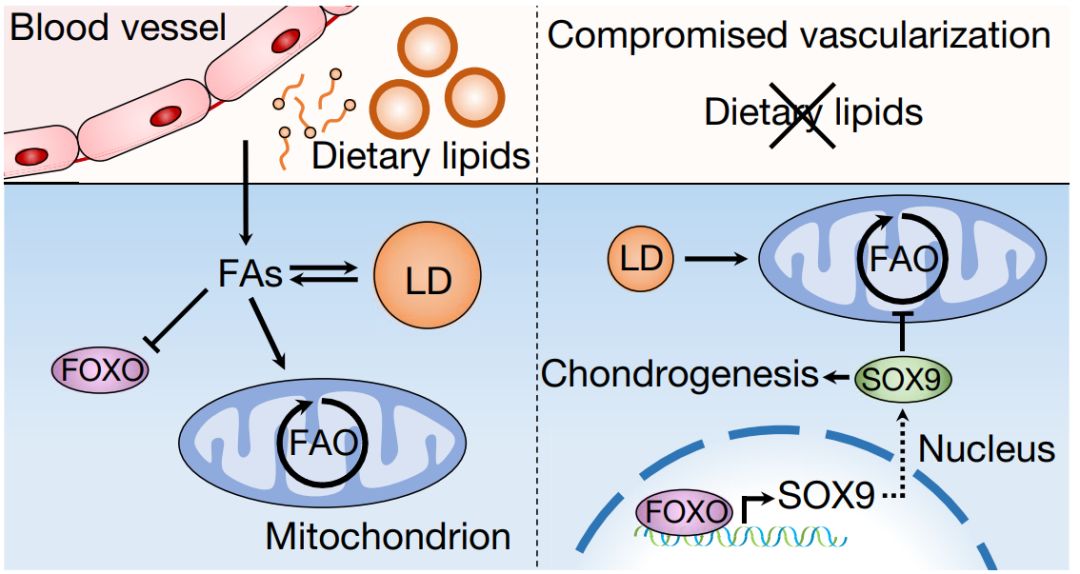 综上所述,脂类含量是软骨内成骨的决定因素,低脂水平下转录因子FOXO被激活后与Sox9启动子结合并促进其表达,代谢调控因子SOX9能通过抑制FAO调节软骨细胞代谢,使软骨细胞适应无血管的特殊微环境。本研究有助于我们理解脂类代谢与营养微环境在骨骼细胞命运决定中的重要作用。
综上所述,脂类含量是软骨内成骨的决定因素,低脂水平下转录因子FOXO被激活后与Sox9启动子结合并促进其表达,代谢调控因子SOX9能通过抑制FAO调节软骨细胞代谢,使软骨细胞适应无血管的特殊微环境。本研究有助于我们理解脂类代谢与营养微环境在骨骼细胞命运决定中的重要作用。
版权申明:本文来源领研网,版权归原作者所有。
文章转摘只为学术传播,如涉及侵权问题,请联系我们,我们将及时修改或删除。
 2020-03-12
2020-03-12
 6912
6912

















